Hinweis: Der Artikel wurde am 13. und 16.8.21 um 4 Studien erweitert.
Ein sogenannter Preprint, also eine noch nicht offiziell begutachtete Vorab-Publikation, zur erhöhten Infektiosität (Ansteckungsfähigkeit) der Delta-Variante hat kürzlich in den (sozialen) Medien und bei vielen Expert*innen Aufsehen erregt.
Zu genau dieser Studie gibt es noch eine Parallelstudie, die weniger bekannt ist, aber weitere epidemiologische und virologische Eigenschaften von Delta zeigt.
Daneben deuten mehrere neue Studien darauf hin, dass die Viruslast (RNA-Konzentration) bei mit Delta infizierten Geimpften und Ungeimpften in den ersten Tagen der Infektion ähnlich ist.
Die Ergebnisse dieser Studien werden nachfolgend vorgestellt, eingeordnet und darauf basierend Überlegungen zu einer dementsprechend angepassten Teststrategie angestellt.
Weiter unten wird als Zusatzinformation das PCR-Pooling (per Lolli oder Gurgeln) mit Antigen-Schnelltests für das regelmäßige Screening in Kitas und Schulen verglichen und der Frage nachgegangen, wie gut Antigentests bei Delta und Geimpften funktionieren. Ein Gesamtfazit findet sich ganz unten im vorliegenden Artikel.
Höhere und schneller ansteigende Viruslast
Zunächst zum eingangs erwähnten Preprint von Li et al.:
Was wurde gemacht? Während eines Delta-Ausbruches wurden (ungeimpfte) Personen mit nachvollziehbarem Kontakt zu einer infizierten Person täglich proaktiv mit einem PCR-Test getestet.
Ergebnisse:
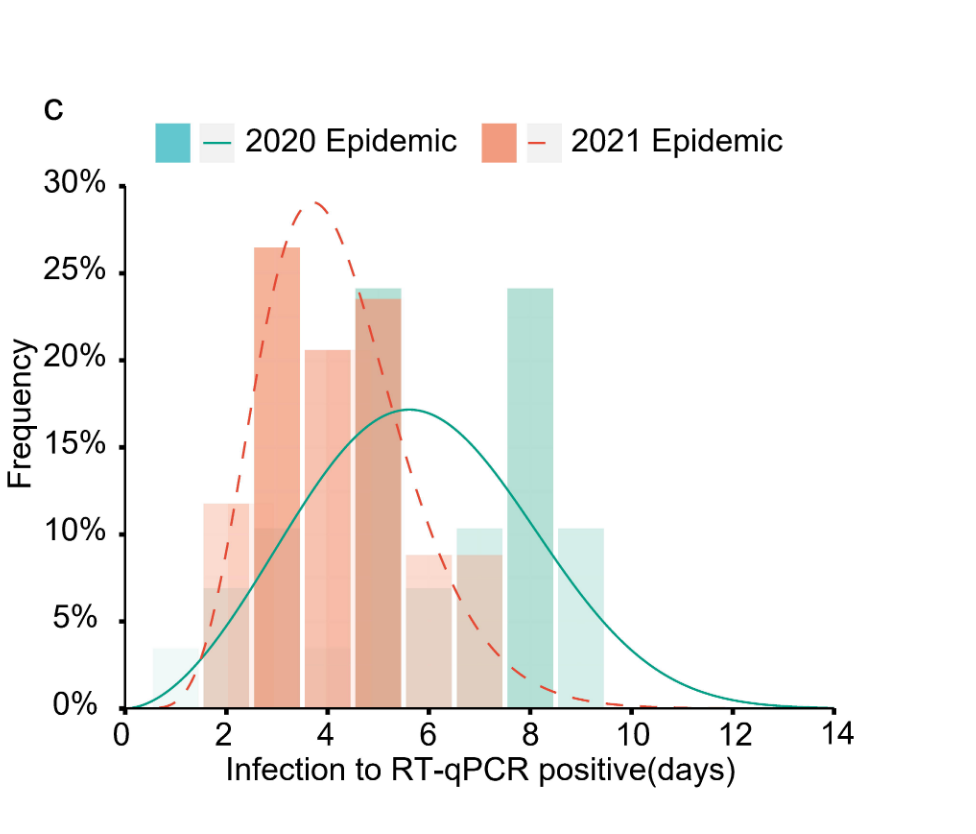
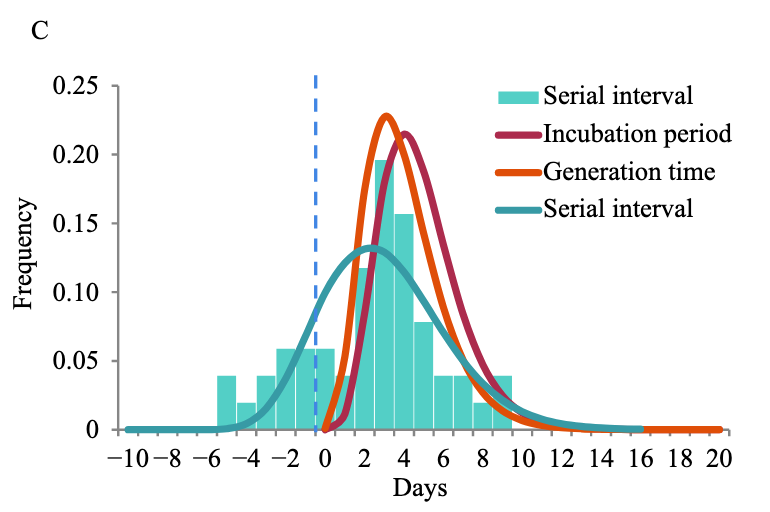
- bei Delta lag der Zeitraum von der Ansteckung bis zum ersten positiven PCR-Test (für 34 Personen [n] nachvollziehbar) im Median bei 4 Tage (Peak: 3,71) vs. 6 Tage (Peak: 5,61) beim (ursprünglichen) Wildtyp (n=29) (siehe Diagramm C)
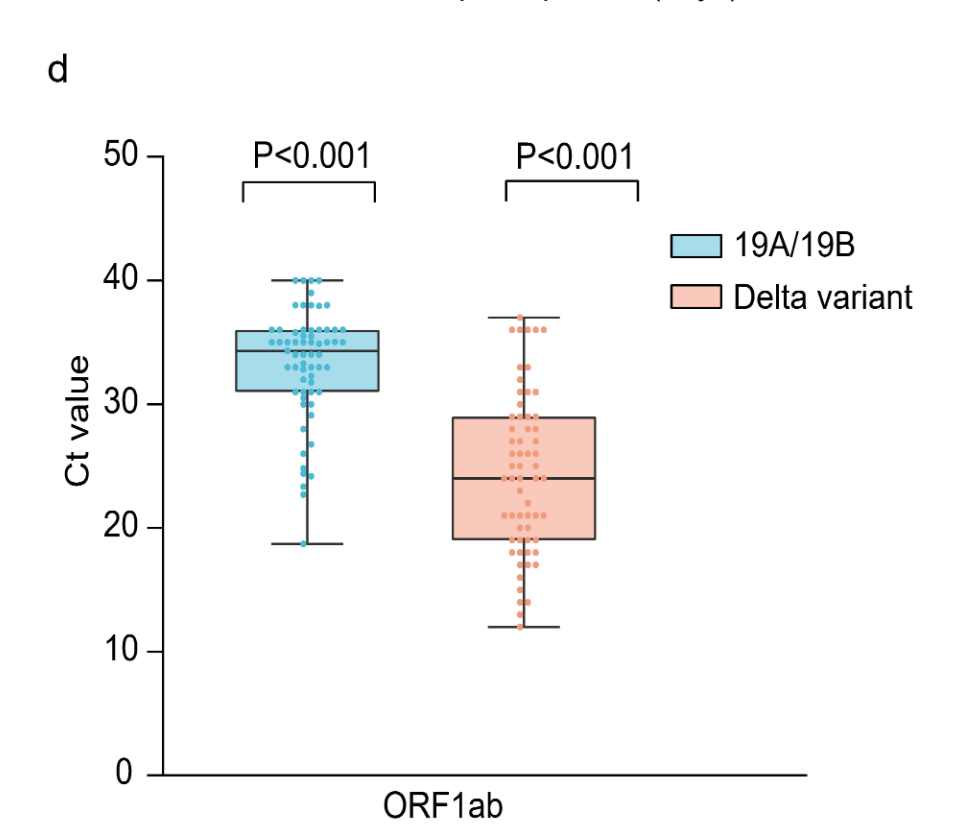
- bei Delta (n=62) war die Viruslast beim ersten positiven PCR-Test im Median 1260-mal höher als beim Wildtyp (n=63) (Ct-Werte: Median 24 vs. 34,31; siehe Diagramm D)
- bei Delta lag (trotz täglicher Tests) beim ersten positiven PCR-Test zu ca. 80% bereits eine i.d.R. ansteckungsfähige Viruslast* vor vs. ca. 19% beim Wildtyp
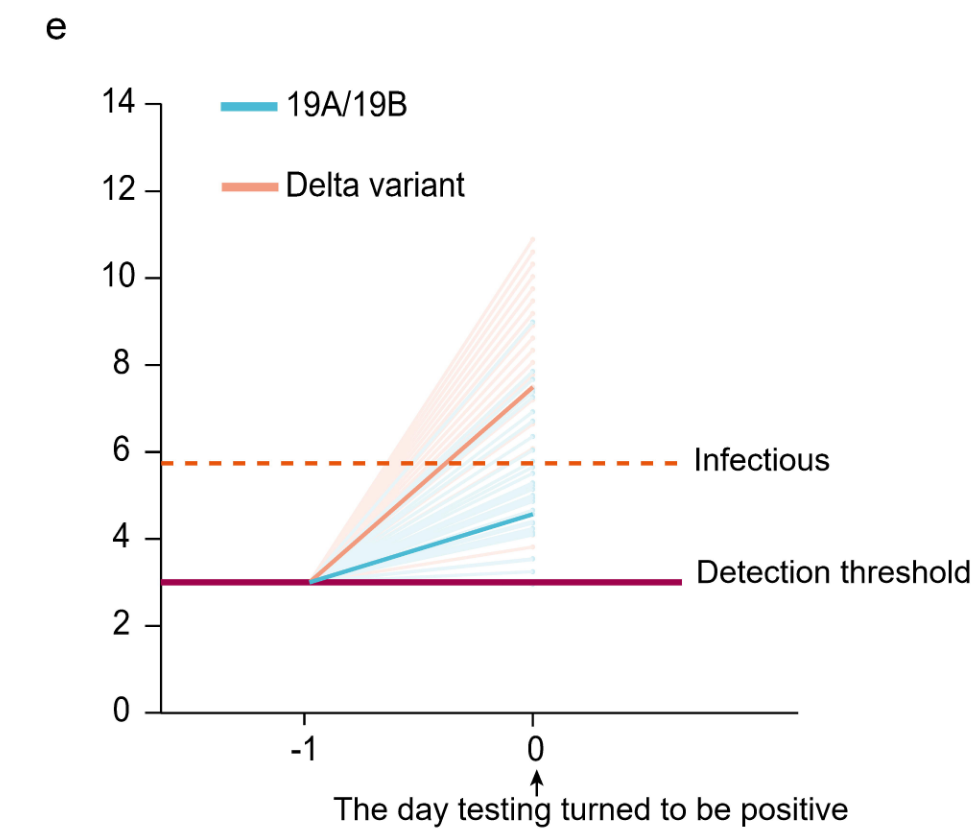
- bei Delta dauerte es im Schnitt ca. 16 Stunden (vom Zeitpunkt ausgehend, an dem erstmals virale RNA durch die PCR nachgewiesen werden kann bzw. hätte können) bis zu einer ansteckungsfähigen Viruslast* vs. ca. 2 Tage beim Wildtyp (siehe Diagramm E)
*entspricht einem Ct-Wert ≤30 bzw. einer Viruslast von ≥6*10^5 RNA-Kopien/ml (darüber bzw. darunter konnte die Studiengruppe kein "lebendes" Virus in Zellkultur mehr anzüchten)
Zum Vergleich:
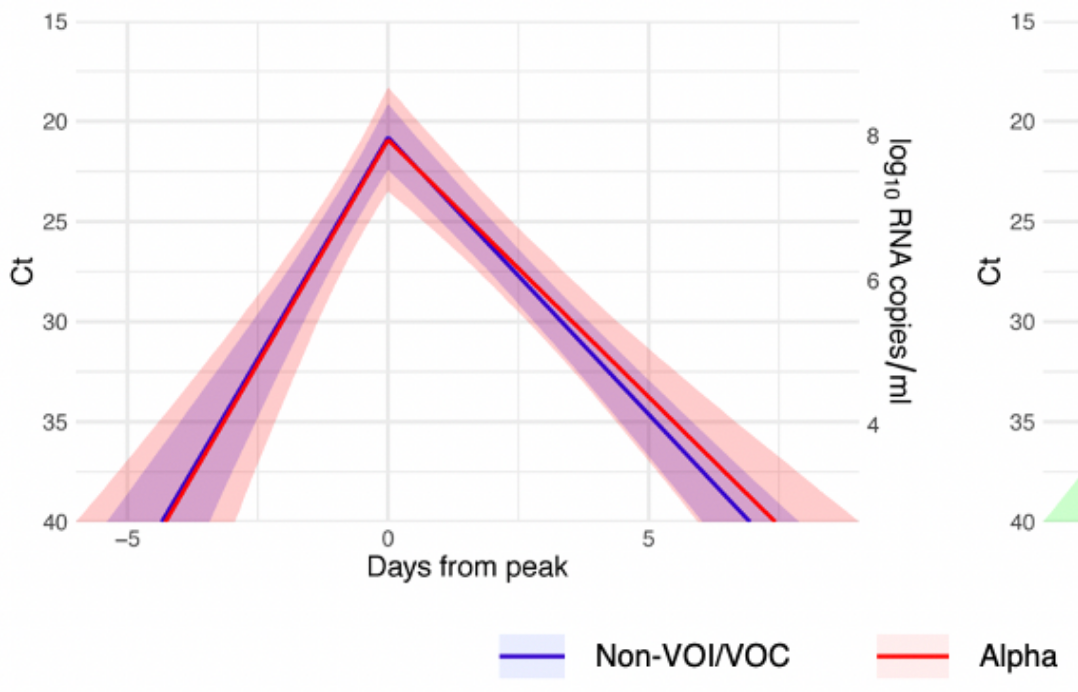
- bei Alpha ist/war die Viruslast - je nach Studie - gar nicht (z.B. Ke et al.) oder im Mittel ca. 10x höher (z.B. Jones et al.) als bei früheren Viruslinien (der Unterschied in den Ergebnissen kann wahrscheinlich methodisch erklärt werden, das würde an der Stelle aber den Rahmen sprengen)
- bei Alpha (und beim Wildtyp) dauert(e) es im Schnitt ca. 2 Tage (vom ersten potenziellen RNA-Nachweiszeitpunkt ausgehend) bis zu einer ansteckungsfähigen Viruslast (Ke et al., Kissler et al.; für Wildtyp: Jones et al., Kissler et al.)
Daraus folgt: Die Viruslast ist bei Delta offensichtlich höher und steigt schneller an.
Ich halte die Daten des Preprints für sehr valide, da hier m.E. die bestmögliche Methodik angewandt wurde, um herauszufinden, ab wann im Infektionsverlauf der PCR-Test positiv wird und mit welcher Viruslast. Vermutlich ist das auch ein Grund, warum dieser Preprint von Expert*innen so viel Anerkennung erhält (vgl. News-Beitrag bei Nature).
Kürzere Inkubations- und Latenzzeit
Nun zur Parallelstudie von Zhang et al., die denselben Ausbruch in Guangdong bzw. die dortigen Übertragungspaare untersuchte und so weitere epidemiologische und virologische Eigenschaften liefert. Update vom 16.8.21: Eine weitere Studie (Preprint) von Kang et al. liefert ebenfalls für denselben Ausbruch entsprechende Daten.
Ergebnisse:
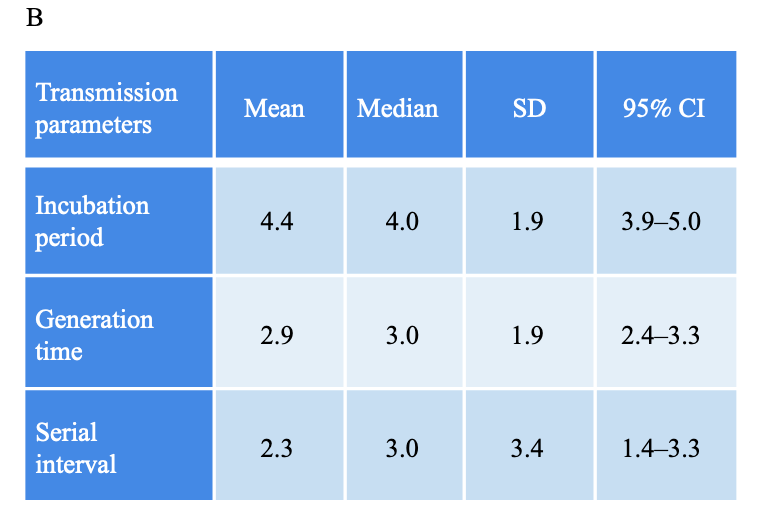
- Inkubationszeit (Zeit von Ansteckung bis Symptombeginn): ⌀4,4 Tage (n=47 in Zhang et al.) bzw. ⌀5,8 Tage (n=95 in Kang et al.)
- Generationszeit (Zeit von Infektion des Indexfalls bis Infektion des Sekundärfalls): ⌀2,9 Tage (n=55 in Zhang et al.)
- serielles Intervall (Zeit von Symptombeginn des Indexfalls bis Symptombeginn des Sekundärfalls): ⌀2,3 Tage (n=51) bzw. Abnahme während des Ausbruches von 6,1 Tage am 25. Mai 2021 bis 4 Tage am 18. Juni 2021 (Kang et al.) bzw. ⌀3,3 Tage (in Singapur bei n=32 in Pung et al.)
- 64,7% (von n=68 in Zhang et al.) bzw. 73,9% (von n=94 in Kang et al.) der Übertragungen fanden vor Symptombeginn statt
- Latenzzeit (Zeit von Ansteckung bis Beginn der Infektiosität): ⌀4 Tage (n=101 in Kang et al.)
Zum Vergleich:
- die Inkubationszeit für den Wildtyp lag laut der neuesten und m.E. methodisch besten Meta-Analyse im Mittel bei 6,3 Tagen (im Median bei 5,4 Tagen) (Xin et al.)
- Generationszeit und serielles Intervall sind keine stabilen Eigenschaften eines Virus, da sie z.B. von der Dauer bis zur Isolation und Quarantäne abhängig sind (Ali et al.); für den Wildtyp schätzt(e) das RKI die Generationszeit auf im Schnitt 4 Tage (an der Heiden et al.) und das serielle Intervall auf im Median 4 Tage (RKI-Steckbrief mit Stand 14.7.21)
- die Latenzzeit vor Delta lag laut einer noch unveröffentlichten systematischen Übersichtsarbeit von Cowling et al. im Mittel bei 5,5 Tage
Daraus folgt: Inkubations- und Latenzzeit sind bei Delta offensichtlich kürzer als beim Wildtyp (vgl. Kang et al.).
Es gibt bestätigende Daten
Die höhere Viruslast bei Delta wird durch einen (auch von der WHO zitierten) Preprint von Ong et al. (der darüber hinaus eine länger andauernde hohe Viruslast bei Delta feststellte), eine US-Studie (Preprint) von Bolze et al. und einen PHE-Bericht vom 25.6.21 bestätigt und Prof. Drosten berichtete ebenfalls am 22.6.2021 von ersten Hinweisen, dass bei Delta die Viruslast noch mal höher als bei Alpha ist.
Schaut man sich die Ergebnisse aus proaktiven asymptomatischen Testungen in England im April 2021 an, so sieht man das ca. 50% der entdeckten Delta-Fälle, aber nur ca. 22% der Alpha-Fälle eine Viruslast von >10 Mio. RNA-Kopien/ml hatten:
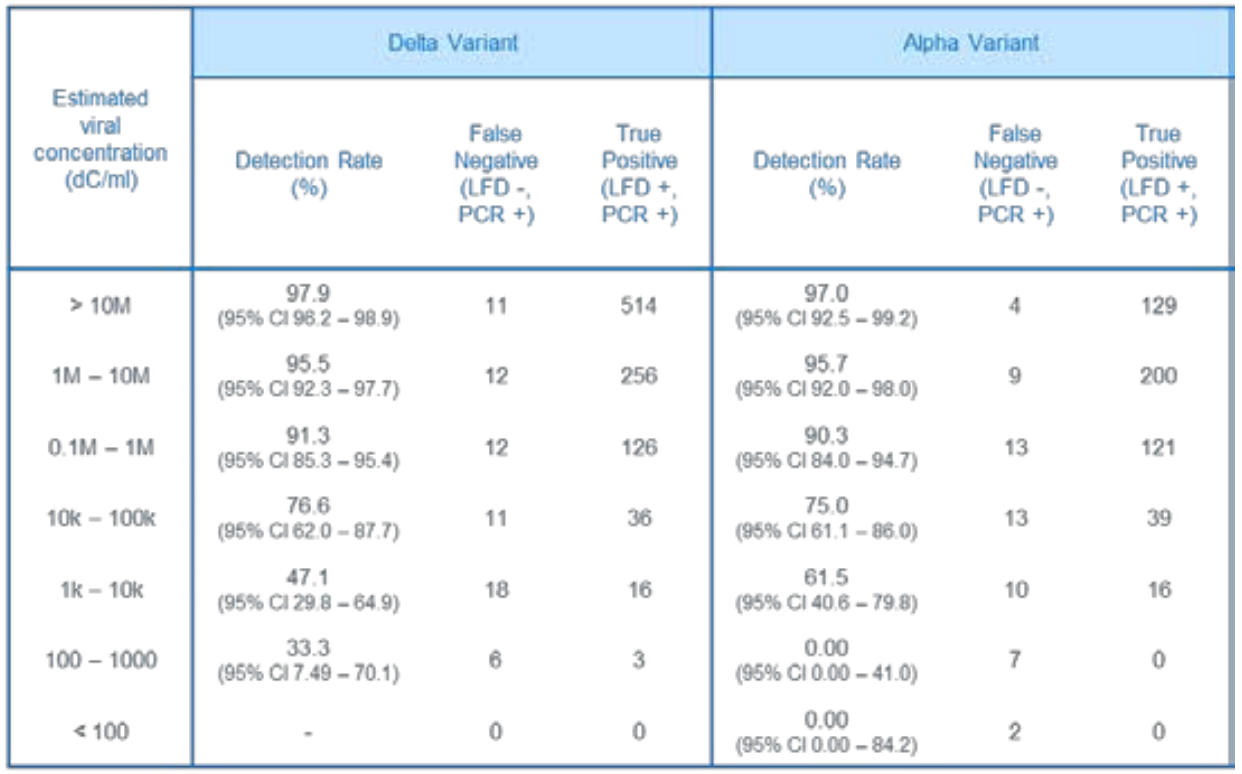
Da sich bei den proaktiven Testungen zudem vermutlich viele in der frühen Infektionsphase befanden, könnten die verhältnismäßig wenigen Delta-Fälle (ca. 22% vs. ca. 39% bei Alpha) mit geringer Viruslast (<1 Mio. RNA-Kopien/ml) ein Hinweis darauf sein, dass die Viruslast bei Delta schneller ansteigt als bei Alpha.
Bestätigend zeigte sich in zwei Studien (Preprints) von Mlcochova et al. (a, b) bei im Labor infizierten humanen Lungen- und Atemwegsepithelzellen (inkl. Organoide) und Affen-Nierenzellen für Delta im Vergleich zu Alpha eine erhöhte Replikations(Wachstums)rate.
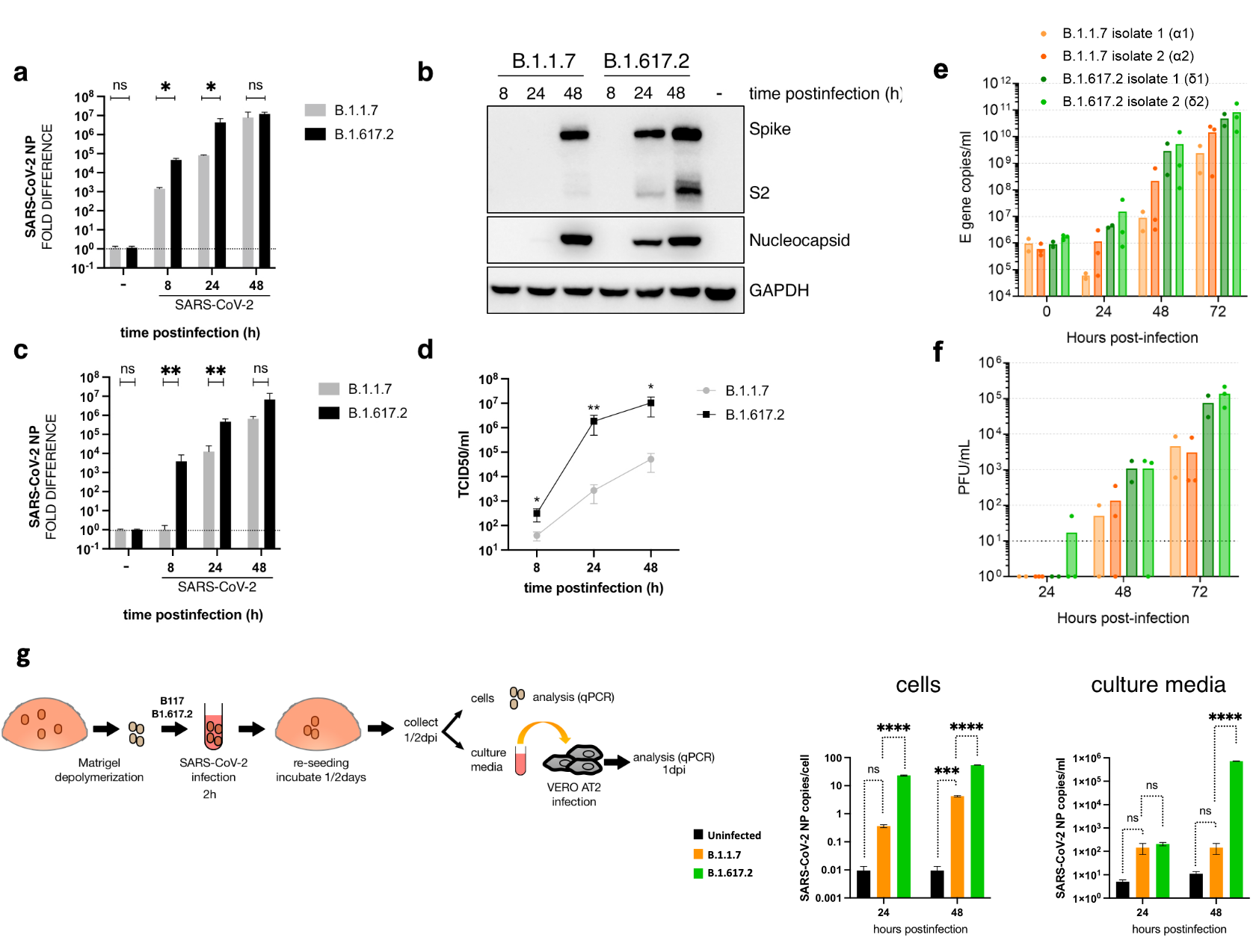
Während es in Mlcochova et al. (a) keinen signifikanten Unterschied in der Viruslast zwischen mit Delta infizierten Geimpften und nicht mit Delta (also mit früheren Viruslinien) infizierten Geimpften gab, lag die Viruslast in Mlcochova et al. (b) bei mit Delta infizierten Geimpften (erwartungsgemäß) signifikant höher als bei nicht mit Delta infizierten Geimpften (Achtung: Hier geht es nicht um den Vergleich zwischen mit Delta infizierten Geimpften und Ungeimpften; siehe dazu den nachfolgenden Abschnitt). Dies ergab auch die "National Passive Surveillance" der US-amerkanischen CDC.
Gleiche Viruslast bei Geimpften?
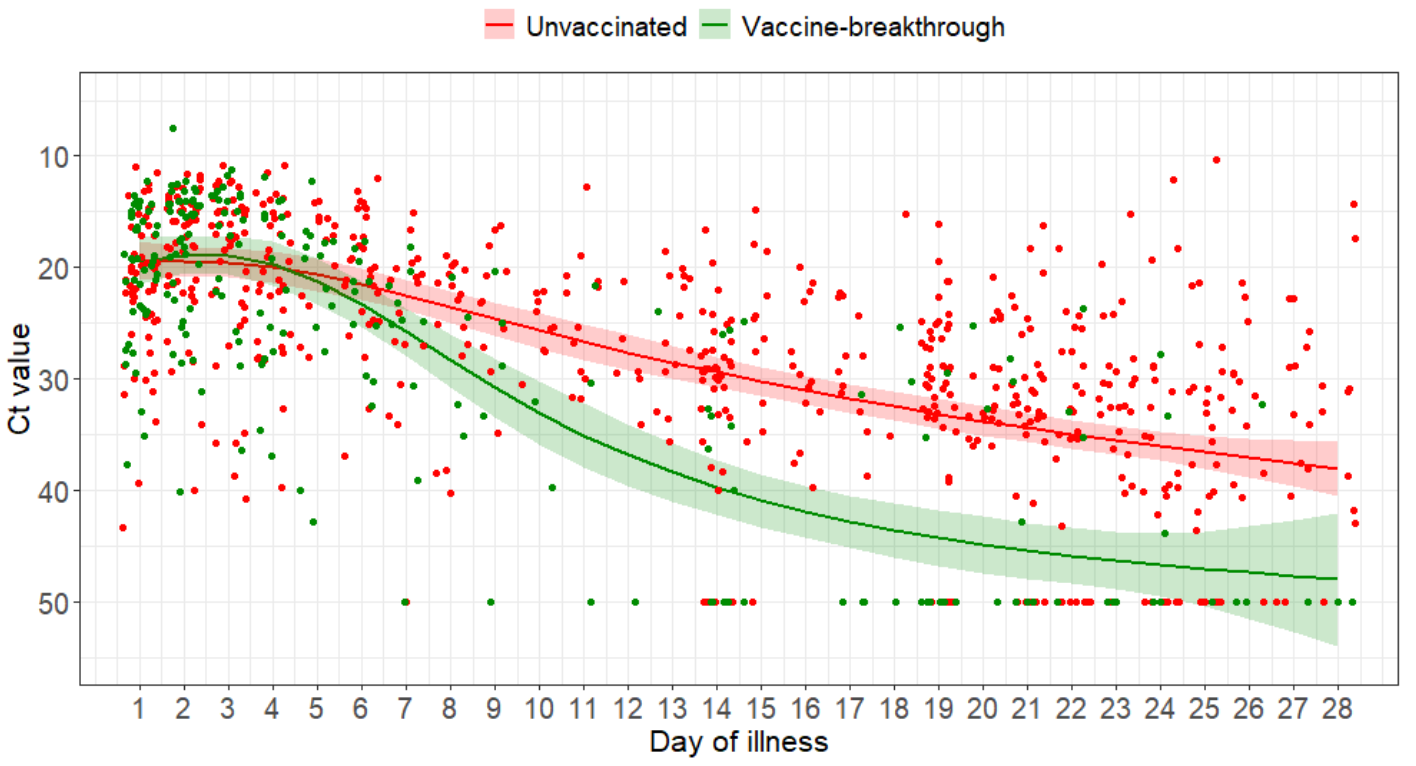
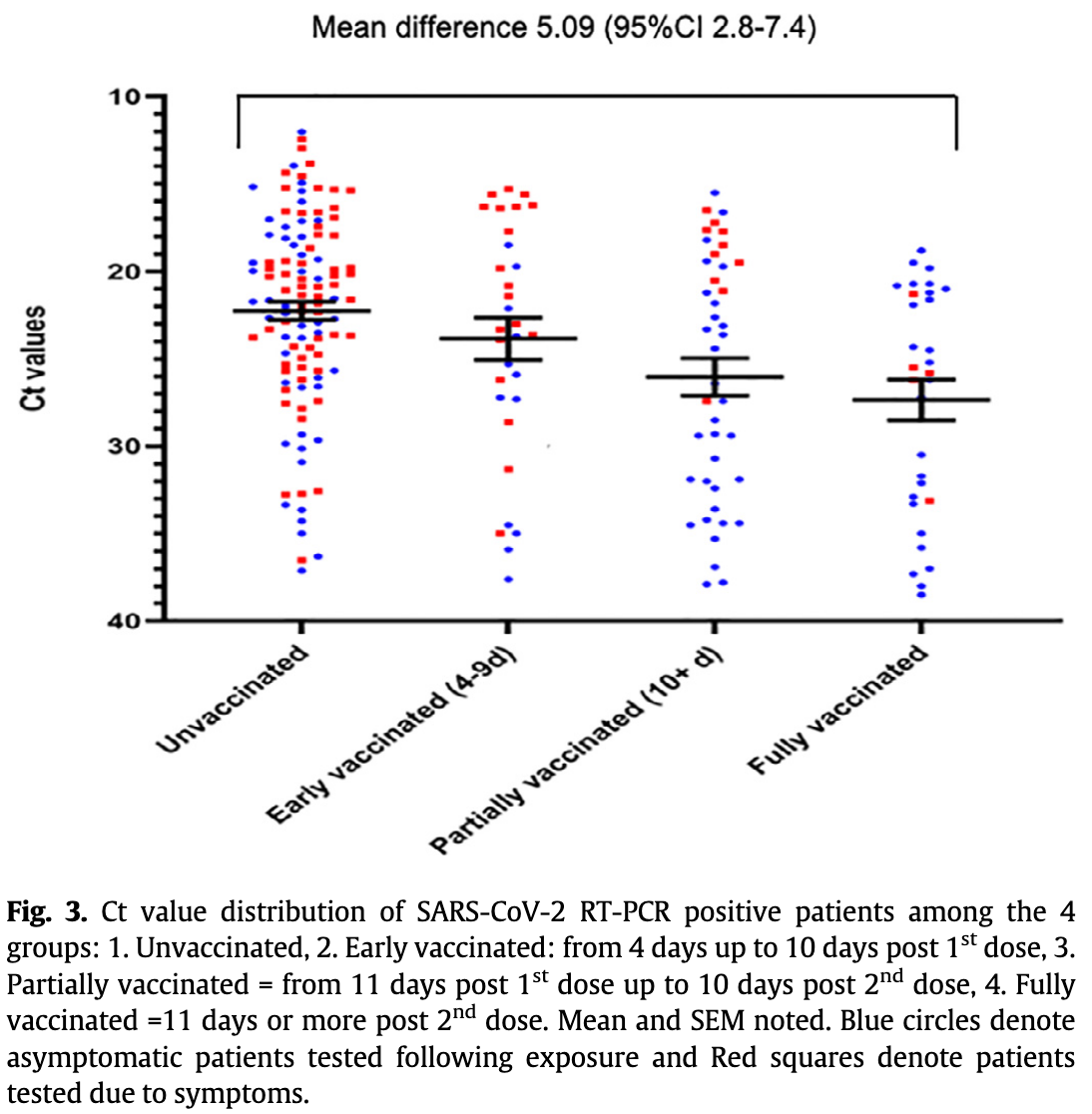
Drei Studien (davon 2 Preprints) und ein aktueller Bericht von "Public Health England" stellten fest, dass die Viruslast (genauer: Ct-Werte, die mit der viralen RNA-Konzentration korrelieren) bei mit Delta infizierten Geimpften und Ungeimpften ähnlich ist (Brown et al., Riemersma et al., Musser et al., PHE-Bericht vom 6.8.21). In einem weiteren Preprint (Chia et al.) wurden mit Delta infizierte Hospitalisierte im Verlauf gescreent und dabei zeigte sich, dass die Viruslast im Schnitt (nur) für ca. 5 Tage nach Symptombeginn bzw. (bei Asymptomatischen) nach dem ersten positiven PCR-Test ähnlich verläuft, dann aber bei den Geimpften durchschnittlich schneller abfällt als bei den Ungeimpften - auch wenn man die Asymptomatischen rausrechnet (diese Info wurde Blanquart et al. entnommen). Sprich: Geimpfte sind wahrscheinlich im Schnitt kürzer ansteckend. Zudem gibt es auch eine Studie (Preprint), die bei Geimpften eine niedrigere Viruslast zeigte (Elliott et al.), was wahrscheinlich daran liegt (und das würde das Vorgesagte bestätigen), dass hier (im Gegensatz zu den anderen Studien) zufällige (und nicht anlassbezogene bzw. frühsymptomatische) Tests erfolgten, wodurch wahrscheinlich relativ oft bei Symptomatischen (die trotz Symptome [erst mal] keinen PCR-Test machen lassen oder erhalten haben) und bei Asymptomatischen (die von ihrer Infektion nichts wussten und die in den anderen Studien unterrepräsentiert waren, vgl. unten) in einer späteren Infektionsphase, in der die Viruslast bei den Geimpften bereits geringer war, (zufällig rein)getestet wurde.
Wichtig:
- In den vorgenannten Studien, die die Viruslast bei mit Delta infizierten Geimpften und Ungeimpften vergleichen, wurde nicht untersucht, ob bzw. wie oft aus den Proben der Infizierten "lebendes" bzw. ansteckungsfähiges Virus in Zellkultur (im Labor) angezüchtet werden kann. Es könnte sein, dass die Korrelation (der Zusammenhang) zwischen Viruslast (RNA-Konzentration) und Ansteckungsfähigkeit/Infektiosität (Anzuchtwahrscheinlichkeit in Zellkultur) bei Geimpften nicht mehr (so stark bzw. über alle Infektionstage) gegeben ist oder dass sich die Infektiositätsschwelle (die Viruslast, ab der man i.d.R. Virus anzüchten kann) bei Geimpften höher liegt.
Update (13.8.21): In einem Update des bereits oben zitierten Preprints von Riemersma et al. wurden einige Proben mit einem Ct-Wert von unter 25 (also mit hoher Viruslast) kultiviert und bei 88% der Ungeimpften (14 von 16) und 95% der Geimpften (37 von 39) konnte Virus angezüchtet werden (einschließlich der einzigen Probe einer/eines asymptomatischen Geimpften). Da in der Studie 91% der von Symptomatischen stammenden Proben im Zeitraum vom Symptombeginn bis Tag 6 danach entnommen wurden, stammten wahrscheinlich fast alle aus den ersten Tagen der Infektion, so dass die Kultivierungsergebnisse als Bestätigung angesehen werden können, dass die meisten mit Delta infizierten Geimpften mit hoher Viruslast (geringem Ct-Wert) in den ersten Tagen der Infektion (wahrscheinlich*) ansteckungsfähig sind (*die Virusanzucht im Labor gilt laut RKI [von Kleist et al.] als "verlässlicher Hinweis auf eine Ansteckungsfähigkeit"). Leider ist unbekannt, welche Viruslast (RNA-Kopien/ml) der Ct-Wert 25 hier entspricht (Ct-Werte sind nicht standardisiert; vgl. weiter unten). - In den Studien (mit Ausnahme der Studie von Elliott et al., die eine geringere Viruslast feststellte) waren kaum Infizierte ohne Symptome (Asymptomatische) dabei (weil diese seltener identifiziert werden). Es könnte sein, dass asymptomatische Geimpfte - ähnlich wie bei asymptomatischen Ungeimpften (Cevik et al., Kissler et al.) - (noch) kürzer eine hohe Viruslast aufweisen als symptomatische Geimpfte. Darauf weist eine (sehr kleine) Follow-Up-Studie von North et al. mit u.a. asymptomatischen Durchbruchsinfektionen bei Alpha (n=4: 2x einfach- und 2x doppelt-geimpft) hin (im Median war der PCR-Test 2 Tage nach dem ersten positiven Test schon wieder negativ und beim Negativ-Test konnte kein Virus in Zellkultur angezüchtet werden). Da die Impfung (auch bei Delta) relativ gut vor (jeglicher) symptomatischer Infektion schützt (siehe unten) und daher der Anteil Asymptomatischer unter Geimpften größer ist als unter Ungeimpften (ca. 20-30% bei ungeimpften Erwachsenen gemäß Buitrago-Garcia et al., Byambasuren et al., Sah et al.), wäre der Viruslast-Vergleich basierend v.a. auf Symptomatischen im Ergebnis verzerrt (die durchschnittliche Viruslast von Geimpften wäre überschätzt).
Update (13.8.21): Bestätigend zum Vorgesagten wurde in Blanquart et al. (Preprint) bei Delta im Schnitt eine signifikant geringere Viruslast bei (zum Testzeitpunkt*) asymptomatischen Geimpften (n=449) gegenüber symptomatischen Geimpften (n=417) und auch gegenüber (zum Testzeitpunkt*) asymptomatischen Ungeimpften (n=3908), aber kein Unterschied zwischen symptomatischen Geimpften und symptomatischen Ungeimpften (n= 2888) festgestellt, wobei leider keine Angaben zum jeweiligen Testzeitpunkt der Asymptomatischen (wie viel Tage nach der Ansteckung, sofern bekannt, fand der Test statt?) gemacht wurden (*da keine Nachuntersuchung erfolgte, kann es sein, dass einige noch Symptome entwickelten).
Im Update des Preprints von Riemersma et al. (vgl. oben) zeigte sich bei Delta ebenfalls im Mittel eine signifikant geringere Viruslast bei (zum Testzeitpunkt) asymptomatischen Geimpften (mit n=12 sehr geringe Fallzahl) gegenüber symptomatischen Geimpften (jedoch kein Unterschied gegenüber asymptomatischen Ungeimpften mit n=24).
In der Studie von Chau et al. (Preprint) wurden mit Delta infizierte Hospitalisierte im Verlauf gescreent. Dabei lag der Peak der Viruslast bei asymptomatischen Geimpften (mit n=13 sehr geringe Fallzahl) im Median signifikant geringer als bei symptomatischen Geimpften (n=49). Auch im Verlauf (ab dem ersten positiven PCR-Test bis zum negativen PCR-Test bei Entlassung aus dem Krankenhaus) lag die Viruslast der asymptomatischen Geimpften zu fast allen Zeitpunkten im Median deutlich geringer (siehe Abbildung unten). Da es sich um einen Ausbruch in einem Krankenhaus handelte, war der Zeitpunkt der Infektion vermutlich in den meisten Fällen derselbe.
Die (neuen) Ergebnisse sprechen dafür, dass bei Delta asymptomatische Geimpfte entweder durchgehend oder ab einem relativ frühen Zeitpunkt im Schnitt eine geringere Viruslast aufweisen als symptomatische Geimpfte, so dass die Ergebnisse aus den zuvor zitierten Studien, die überwiegend symptomatische Ungeimpfte und Geimpfte verglichen, die durchschnittliche Viruslast von (allen) Geimpften überschätzen, weil der Anteil Asymptomatischer unter Geimpften größer ist als unter Ungeimpften (vgl. oben).
- Die Impfung schützt bei Delta weiterhin relativ gut vor (jeglicher) symptomatischer Infektion (hier weichen israelische Daten etwas ab), in hohem Maße vor schwerer Erkrankung inkl. Tod (siehe zusammengefasste Daten vom 7.8.21 von Eric Topol bzw. als Primärliteratur z.B. den PHE-Bericht vom 5.8.21 [England: AstraZeneca & BioNTech] oder Sisonke-Bericht vom 6.8.21 [Südafrika: J&J]) und auch zu einem gewissen Grad vor (jeglicher) Infektion (z.B. 49% laut Elliot et al. für den Zeitraum 24.6.-12.7.21 in England). Durch den (teilweisen) Schutz vor Infektion schützt die Impfung indirekt auch vor einer Übertragung durch Geimpfte (vgl. Richtermann et al.).
- Studiendaten vor Delta zeigen: Die Wahrscheinlichkeit einer Übertragung lag in einem 4-Personen-Haushalt zwischen 2 Ungeimpften bei 59%, zwischen 2 Geimpften aber nur bei 4% (Layan et al.). Nach einer Impfdosis konnte eine Risikoreduktion einer Übertragung auf ungeimpfte Haushaltsmitglieder von 30-50% (Harris et al., Shah et al.), nach zwei Impfdosen von 54-73% festgestellt werden (de Gier et al., Shah et al.). Bei Delta werden die Werte voraussichtlich etwas schlechter ausfallen, aber die Daten zeigen, dass die Impfung nicht nur einen Eigen-, sondern auch einen gewissen Fremdschutz bietet.
Zwischenfazit: Auch wenn die vorgenannten Studien jeweils Limitationen haben (siehe den jeweiligen Diskussionsteil der Studien; v.a. oft kleine bis mittlere Fallzahl, die zu statistischen Unsicherheiten führt), lässt sich daraus m.E. grundsätzlich schlussfolgern, dass mit Delta Infizierte eine höhere Viruslast aufweisen, die schneller ansteigt und eventuell auch länger andauert (jeweils im Schnitt im Vergleich zum Wildtyp und zu Alpha), und dass die Viruslast bei mit Delta infizierten Geimpften wahrscheinlich (nur) in den ersten Tagen der Infektion durchschnittlich ähnlich ist wie bei Ungeimpften, wobei asymptomatische Geimpfte wahrscheinlich im Mittel entweder durchgehend oder (noch) früher eine geringere Viruslast als symptomatische Geimpfte aufweisen. Zudem ist noch unklar, wie der Zusammenhang zwischen Viruslast und Infektiosität bei Geimpften (über den Infektionsverlauf) aussieht.
Welche Optimierungen an unserer Teststrategie machen die Studienergebnisse m.E. erforderlich?
Auch Geimpfte testen, Gültigkeitsdauer reduzieren, Frequenz erhöhen, schneller werden
Vorab (aus aktuellem Anlass): Die Bürger*innentests sollten m.E. (mind. 1x/Woche) kostenlos bleiben. Der Plan des Bundesgesundheitsministeriums vom 2.8.21, diese (mit Ausnahme für Personen, die sich nicht impfen lassen können bzw. für die keine allgemeine Impfempfehlung vorliegt) für alle kostenpflichtig zu machen, suggeriert bzw. impliziert m.E., dass Geimpfte (und Genesene) sich generell nicht mehr regelmäßig testen sollen und für bestimmte Veranstaltungen o.Ä. (wozu z.B. auch Besuche in Alten- und Pflegeheimen gelten) nicht mehr testen müssen. Das halte ich mit Blick auf die obigen Daten und den im Herbst/Winter zu erwartenden höheren Inzidenzen (vgl. RKI-Papier vom 22.7.21) für falsch. (Zur Frage, wie gut Antigentests bei Delta und Geimpften funktionieren, siehe weiter unten.) Schnelltests haben in Deutschland in der "3. Welle" (flächendeckend und regelmäßig ab Mitte März 2021 angewandt) entscheidend mit zur Senkung der Fallzahlen beigetragen (Gabler et al., Mohring et al.). Dass so eine niederschwellige Maßnahme ("Käsescheibe") bei erster Gelegenheit (in einer laut RKI bereits beginnenden "4. Welle") zurückgefahren werden (soll), ist für mich unverständlich. Bis wirklich alle bei uns ein Impfangebot erhalten haben, sollten wir diese (neben u.a. dem Mund-Nasen-Schutz als ähnlich niederschwellige Maßnahme) m.E. beibehalten. Auch weil Geimpfte öfters asymptomatisch* als Ungeimpfte sind (siehe oben) und daher unbemerkt das Virus (z.B. auf Personen, die sich [noch] nicht impfen lassen können/dürfen oder bei denen die Impfung versagt) übertragen können. Zudem ist es m.E. nicht unwahrscheinlich, dass auch (symptomatische) Geimpfte (teilweise) vor Symptombeginn ansteckend (präsymptomatisch) sein können (Update vom 13.8.21: Bestätigt durch den Preprint von Chau et al.).
*Asymptomatische Geimpfte sind eventuell (noch) kürzer ansteckend als symptomatische Geimpfte (siehe oben) und übertragen das Virus wahrscheinlich u.a. durch das ausbleibende Husten, Niesen etc. seltener pro Kontakt (vgl. für Ungeimpfte: Buitrago-Garcia et al., Byambasuren et al., Qiu et al.), wobei Asymptomatische in der ansteckenden Phase möglicherweise im Schnitt mehr Kontakte haben als Symptomatische bis zu deren etwaigen Isolation, sofern Asymptomatische nicht (mehr) vorzeitig bei einem proaktiven Screening-Test erkannt werden.
Beim "Freitesten" sollte m.E. die Gültigkeitsdauer von PCR- und Antigen-Schnellttests ggf. reduziert werden. Mindestens auf 48 Stunden (PCR; beginnend ab dem Abstrichzeitpunkt!) bzw. 24 Stunden (Antigentest) bzw. je nach Setting besser auf 24 Stunden (PCR) bzw. mit tagesaktuellem Ergebnis (Antigentest).
Beim Screening (regelmäßige Tests, egal welcher Art; vgl. weiter unten) in Schulen und Kitas sollte m.E. bei weiter steigenden Inzidenzen (in der jeweiligen Altersgruppe) die Frequenz ggf. von 2x auf 3x/Woche erhöht werden. (Nach den Ferien sollten m.E. an den ersten 1-2 Tagen - selbst wenn parallel am 1. oder 2. Tag per PCR-Pooling getestet wird - Antigen-Selbsttests durchgeführt werden. Zusätzlich sollte man m.E. die Eltern/Kinder/Jugendlichen darum bitten, am Tag vor Kita-/Schulstart einen Selbsttest durchzuführen.) Arbeitnehmer*innen (die nicht ausschließlich im Homeoffice arbeiten) sollten m.E. weiter 2 Tests/Woche kostenlos angeboten bekommen und diese - unabhängig vom Impf-/Genesenenstatus - dazu motiviert werden, das Angebot zu nutzen. In Alten- und Pflegeheimen sollten m.E. neben dem Personal auch die Bewohner*innen (weiter/wieder) regelmäßig getestet werden.
TTI (test, trace, isolate): Zu jedem PCR-Test sollte m.E. (sofern kein positiver Selbst- oder Schnelltest vorausging) parallel ein Point-of-Care-Schnelltest erfolgen. Sofern Letzterer positiv ist (bei Symptomen ist die Vortestwahrscheinlichkeit sehr hoch), sollte der/die Getestete m.E. dazu angehalten werden, seine kürzlichen engen Kontaktpersonen inkl. Haushaltsmitglieder umgehend zu informieren, damit diese sich je nach Impf-/Genesenenstatus quarantänisieren bzw. vorsichtiger verhalten und/oder selbst testen oder testen lassen können (auch für positive Selbsttests im Privatbereich m.E. empfehlenswert).
Generell: Da v.a. die frühen Symptome sehr vielfältig und unspezifsch sind (z.B. Böhmer et al., Elliott et al.), sollte man - unabhängig vom Impf-/Genesenenstatus - m.E. bei den minimalsten Symptomen (z.B. Halskratzen, laufende Nase, Muskelschmerzen) einen Selbsttest machen und, falls negativ, am Folgetag noch einen (nicht jede*r ist zu Symptombeginn bereits ansteckend). Positive Selbst-/Schnelltests sollten m.E. (weiterhin) schnellstmöglich mit PCR bestätigt werden. Wichtig: Bei einem eindeutige(re)n Verdacht (z.B. als Kontaktperson, bei mehreren leichten Symptomen, bei moderaten/schweren Symptomen, bei spezifischen Symptomen wie Fieber, trockener Husten und/oder Geschmacks-/Geruchsverlust) sollte man immer eine*n Ärztin/Arzt, den kassenärtlichen Bereitschaftsdienst und/oder das Gesundheitsamt kontaktieren (auch wenn der Selbst-/Schnelltest negativ ist) und sich selbst isolieren (gilt bei Symptomen auch für Geimpfte/Genesene). Daneben sollte man sich m.E. regelmäßig, mindestens anlassbezogen (z.B. vor Besuch der [Groß-]Eltern), selbst testen (oder testen lassen).
Um solch ein niederschwelliges Testen zu ermöglichen, sollten Selbsttests m.E. endlich (wie z.B. in England 2x/Woche oder Österreich 10x/Monat) kostenfrei zur Verfügung gestellt werden (auch 1€/Test stellt eine Hürde dar) und deren Nutzen und Limitationen* weitreichend und zielgruppengerecht (über alle Kanäle) kommuniziert werden (vgl. Betsch et al.) sowie (generell) die Isolation/Quarantäne unterstützt werden (vgl. Cevik et al., Smith et al., Patel et al., Isherwood et al.).
*Die Stärke der Schnelltests liegt m.E. als Public-Health-Maßnahme bzw. als regelmäßiger Screening-Test in der Identifikation von Positiven (v.a. von Ansteckenden) und nicht als "Freitest" in der Bescheinigung von Negativen (vgl. Mina & Anderson).
Zwischenfazit: (Auch) Geimpfte und Genesene sollten sich m.E. (weiter) proaktiv regelmäßig testen oder (kostenlos) testen lassen (können). Die Gültigkeitsdauer eines Testergebnisses sollte m.E. ggf. (auf 24 Stunden. bzw. Tagesaktualität) reduziert und die Frequenz bei regelmäßigen Screening-Tests ggf. (auf 3x/Woche) erhöht werden. Generell müssen wir m.E. in der Erkennung Infizierter und Kontaktrückverfolgung (noch) schneller werden, so dass ein dem PCR-Test vorgeschalteter Selbst- oder Schnelltest für einen Zeitgewinn sorgen kann.
Hinweis: Der nachfolgende Part kann m.E. als Zusatzinformation angesehen werden. Es wird das PCR-Pooling mit Antigen-Schnelltests als Screening-Tool verglichen und der Frage nachgegangen, wie gut Antigentests bei Delta und Geimpften funktionieren. (Ein Gesamtfazit findet sich ganz unten im vorliegenden Artikel.)
Pooling vs. Antigen-Schnelltests: Hauptsache regelmäßig
Eine Alternative zu den Antigen-Selbsttests für Kitas und Schulen ist das PCR-Pooling per Lolli (vgl. Dewald et al., Seifried et al.) oder Gurgeln (vgl. Willeit et al., "WICOVIR"-Studie).
PCR-Pooling ist sensitiver (empfindlicher) als die Antigen-Selbsttests, das heißt, es werden geringere Viruslasten erkannt (je nach Verfahren ≥10^3-10^4 RNA-Kopien/ml vs. ≥10^6 RNA-Kopien/ml), wodurch man Infizierte bestenfalls in der noch nicht ansteckenden Phase (bei Ungeimpften i.d.R. <10^6 RNA-Kopien/ml) entdecken kann. Der Nachteil gegenüber Schnelltests ist das verzögerte Ergebnis (nach dem Kita-/Schultag vorliegend), so dass ggf. zum Testzeitpunkt bereits ansteckende oder bis zum Ergebnis anteckend werdende Personen bis zur Ergebnismitteilung nicht isoliert sind/werden. Andererseits übersehen Schnelltests im Schnitt auch ca. 5-10% mit hohen/ansteckungsfähigen Viruslasten (Brümmer et al., Dinnes et al., Scheiblauer et al.). (Das passiert nicht systematisch, der nächste Test würde i.d.R. anschlagen, sofern die Viruslast noch hoch ist.)
Wichtig: Die auf Beobachtungen aus April 2021 beruhende Arbeitshypothese von Herrn Prof. Drosten, dass Antigentests grundsätzlich die ersten (1 bis) 3 infektiösen Tage (größtensteils) übersehen, hat sich durch Real-Life-Studien (Screening- und klinische Studien), auf die er wartend hinwies, zum Glück nicht bestätigt (siehe dazu ausführlich meinen bis heute mehrmals geupdateten wissenschaftlichen Beitrag, in dem auch erläutert wird, wie Prof. Drostens "damaligen" Beobachtungen m.E. erklärbar sind).
Bei Alpha (und dem Wildtyp) dauerte es - wie weiter oben geschildert - im Schnitt ca. 2 Tage (vom ersten potenziellen RNA-Nachweiszeitpunkt ausgehend) bis zu einer ansteckungsfähigen Viruslast (Ke et al., Kissler et al.; für Wildtyp: Jones et al., Kissler et al.). Hier war das PCR-Pooling bei regelmäßigen Tests m.E. eindeutig im Vorteil, da man oft in diese noch nicht ansteckende Phase hineintestete (vgl. noch nicht veröffentlichte "WICOVIR"-Studie, in der bei 9 Fällen 8-mal der Gurgeltest früher als der Antigen-Selbsttest anschlug).
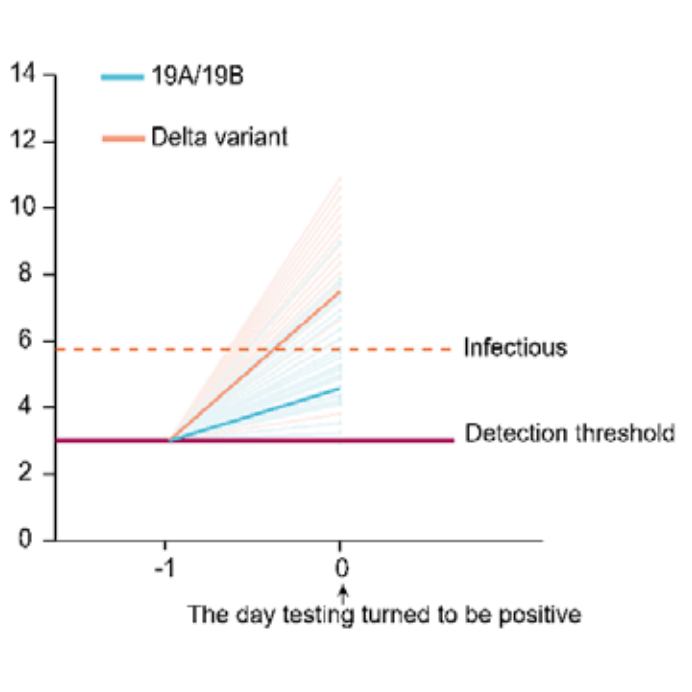
Bei Delta dauert es nun laut dem Preprint von Li et al. (vgl. oben) im Schnitt nur ca. 16 Stunden (vom ersten potenziellen RNA-Nachweiszeitpunkt ausgehend) bis zu einer ansteckungsfähigen Viruslast. Der Vorteil der PCR bzw. des Poolings, eine Infektion früher zu erkennen, wird damit deutlich geringer. In der Studie von Li et al. wurde täglich proaktiv mit PCR getestet und trotzdem lag bereits zum Abstrichzeitpunkt (vs. Ergebniszeitpunkt) der ersten positiven PCR bei ca. 80% der Infizierten eine (bei Ungeimpften) i.d.R. ansteckungsfähige Viruslast vor. Von diesen ca. 80% hätte der Antigen-Selbsttest ca. 95%* sofort erkannt und isoliert (vgl. Grafik 4 im DHSC-Bericht vom 7.7.21), während das Pooling-Ergebnis erst nach dem Kita-/Schultag vorgelegen hätte.
*Gilt für Delta, einer Viruslast von ≥10^6 RNA-Kopien/ml und den (wahrscheinlich von Erwachsenen) im Real Life durchgeführten und üblicherweise in Großbritannien verwandten Antigen-Selbsttest, der (bei Alpha) eine ähnliche Nachweisgrenze besitzt wie die in Deutschland üblicherweise verwandten Antigentests (Kontogianni et al.).
Theoretisch werden also beim regelmäßigen Screening mit Antigen-Selbsttests nun wahrscheinlich mehr Übertragungen verhindert als beim Pooling (vgl. das Modell von Larremore et al., in denen man die Parameter für Delta entsprechend ändern kann). Praktisch könnte die Bilanz gerade bei Jüngeren weniger eindeutig ausfallen. Zwar verzeihen Antigen-Selbsttests (bei hohen Viruslasten) kleine Fehler (Abweichungen von der Gebrauchsanweisung) (Lindner et al., Cassuto et al.) und die Sensitivität nimmt mit der Erfahrung offenbar zu (DHSC-Bericht vom 7.7.21), aber erfahrungsgemäß ist der (vordere) Nasenabstrich für Kita-Kinder nicht immer angenehm. Zwar könnte man hier auf Lolli-Antigentests zurückgreifen, jedoch liegen dazu im Gegensatz zu den Antigentests mit Nasenabstrich nur unzureichend unabhängige Validierungsdaten vor, so dass ich für Kitas das PCR-Pooling via Lolli bevorzugen würde.
Erfahrungsgemäß kommen Grundschüler*innen (mittlerweile) gut mit den Antigen-Selbsttests zurecht, wobei es auch Ausnahmen gibt und die Erstklässler*innen nach den Ferien zunächst unerfahren sein werden. Bei nun wieder vollen Klassen würde ich aber (minimal) zum Pooling via Lolli oder Gurgeln (Letzteres zu Hause durchgeführt) tendieren.
Bei älteren Schüler*innen könnten die Antigen-Selbsttests nun sogar (leicht) im Vorteil sein (zudem würden die PCR-Kapazitäten mutmaßlich sowieso nicht für das Pooling bei höheren Inzidenzen in allen Kitas und Schulen ausreichen). Man könnte das Pooling übrigens (bei höheren Inzidenzen) auch mit Antigen-Selbsttests kombinieren (z.B. Mo: Selbsttest, Di+Do: Pooling; oder als Nachtest Antigen-Schnelltests anstatt individuelle PCR-Tests nutzen [siehe Pollock et al.]), um die Frequenz zu erhöhen bzw. PCR-Kapazitäten einzusparen.
Entscheidender als die Frage "Pooling oder Antigen-Selbsttests?" ist für mich aber, dass auf jeden Fall regelmäßig (siehe weiter oben) getestet wird!
Antigentests bei Delta und Geimpften
Der in England üblicherweise verwandte Antigen-Selbsttest zeigte bei asymptomatischen Testungen bei Delta ähnliche Ergebnisse (Sensitivität bei hohen Viruslasten >95% relativ zur PCR) wie bei Alpha (DHSC-Bericht vom 7.7.21). Interessanterweise war die analytische Sensitivität (im Labor) etwas geringer als bei Alpha. Davon hörte ich auch schon aus einem bekannten Labor in der Schweiz, wobei letztlich die klinische/reale Sensitivität (siehe Satz 1) entscheidend ist. Der üblicherweise in den USA verwandten Antigentest funktioniert ebenso bei Delta (Frediani et al.) und einzelne deutsche Hersteller bestätigten das auch bereits.
Sowohl die schneller ansteigende als auch höhere Viruslast (siehe ausführlich oben) führt wahrscheinlich zu weniger falsch-negativen Ergebnissen (also einer höheren Sensitivität relativ zur PCR gemessen) bei Antigen-Schnelltests, da diese nun sehr wahrscheinlich früher und zuverlässiger anschlagen werden.
Prof. Drosten hatte vor ein paar Wochen (basierend auf Erfahrungen bei Influenza) die Sorge geäußert, dass Antigentests bei Geimpften (und Genesenen) eventuell übermäßig an Sensitivität (Empfindlichkeit) verlieren werden. Erstens weil bei infizierten Geimpften die Viruslast im Durchschnitt geringer sei (Antigentests schlagen bevorzugt bei hohen Viruslasten an) und zweitens weil die durch die Impfung induzierten (gebildeten) Antikörper die Nachweisreaktion des Antigentests stören könnten. Zur Erläuterung: Antigentests weisen Antigene (Virusbausteine) durch die Bindung mit im Test verankerten Antikörpern nach. Wenn nun aber die durch die Impfung induzierten Antikörper die Bindungsstellen am Virus teilweise belegen würden, könnte der Test weniger Antigene nachweisen. Allerdings testen so gut wie alle Antigentests auf das N-Protein (Antigen), eine Impfung induziert aber nur spezifische Antikörper gegen das S-Protein (Antigen), so dass diesbezüglich meiner Meinung nach keine Störung der Nachweisreaktion bei Geimpften zu erwarten ist (Update vom 3.9.21: Prof. Drosten bestätigt das in Folge 97 des NDR Info-Podcasts "Coronavirus Update"). Dass mit Delta infizierte Geimpfte und Ungeimpfte (in den ersten Tagen der Infektion) eine ähnliche Viruslast aufweisen (in allen mir bekannten 8 Studien mit Daten vor Delta hatten Geimpfte im Schnitt eine niedrigere Viruslast [z.B. Emary et al., Pritchard et al., Regev-Yochay et al.]), konnte Prof. Drosten "damals" natürlich noch nicht wissen, jedoch ist dieser Grund für eine zu erwartende geringere Sensitivität praktisch (weil man sich symptomatisch und bei regelmäßigen asymptomatischen Screenings i.d.R. in den ersten Tagen der Infektion schnelltesten wird) damit wahrscheinlich größtenteils hinfällig geworden. Trotzdem kann es natürlich sein, dass es (aus anderen Gründen) zu einer (teilweisen) Störung der Nachweisreaktion bei Geimpften kommen kann.
Bisher haben zahlreiche Studien (immerhin) gezeigt, das Antigentests grundsätzlich bei Geimpften funktionieren können (z.B. Regev-Yochay et al., Bergwerk et al., Young-Xu et al., Schiavone et al., Rubin et al., Garvey et al.). Daraus hervorzuheben sind m.E. zwei Studien derselben Forschungsgruppe (Regev-Yochay et al., Bergwerk et al.), da diese auch den Zusammenhang zwischen Viruslast (Ct-Wert) und Sensitivität (grob) untersuchten. Die in den Studien genutzten Antigentests zeigten bei infizierten Doppelt-Geimpften und einem Ct-Wert von unter 30 eine Sensitivität von 50% (10 von 20 wurden erkannt; siehe unten Grafik 3) bzw. von 57% (17 von 29). Das klingt erst mal wenig, wenn man bedenkt, dass es oft heißt, dass man bis Ct 30 (teils auch darüber hinaus) ansteckend sein kann. Das Problem ist, dass Ct-Werte nicht standardisiert sind. Diese geringen Sensitivitätswerte für Ct<30 (immer relativ zur PCR gemessen) sind aus etlichen Studien bekannt (z.B. Wagenhäuser et al., García-Fiñana et al.), in denen jedoch die Viruslast, ab der man (als Ungeimpfter) laut RKI i.d.R. ansteckungsfähig ist (10^6 RNA-Kopien/ml), einem Ct-Wert von 18,3 bzw. 21,3 entsprach (und nicht 30). Die Unterschiede in der Kalibrierung sind also teils enorm. Von daher kann man ohne Viruslast-Angabe die Performance eines Antigentests (der i.d.R. Viruslasten ≥10^6 relativ zuverlässig nachweist) nur schlecht bewerten (vgl. Mina et al.). Auf den ersten Blick auffällig in der Studie von Regev-Yochay et al. ist, dass die Sensitivität bei Ungeimpften für Ct<30 mit 84% höher lag (vs. 50% bei Doppelt-Geimpften). Da der Ct-Mittelwert unter Ct 30 bei den Geimpften jedoch etwas höher lag (= geringere Viruslast), könnte dies zumindest teilweise die geringere Sensitivität bei diesen erklären. Leider ist in der Studiengrafik 3 nicht ersichtlich, bei welchen Datenpunkten (Ct-Werten) der Antigentest positiv oder negativ war (und auch nicht welcher von den vier in der Studie genutzten Antigentests jeweils genutzt wurde), um einen möglichen Zusammenhang abzuleiten.
Die Studie von Bergwerk et al. bzw. deren Grafik 3 liefert zumindest einen Hinweis darauf, dass die Korrelation (der Zusammenhang) zwischen der Sensitivität des Antigentests und der Viruslast (Ct-Wert) auch bei Geimpften bestehen bleiben könnte, wobei hier leider nicht alle Antigentest-Ergebnisse der infizierten Doppelt-Geimpften abgebildet sind.
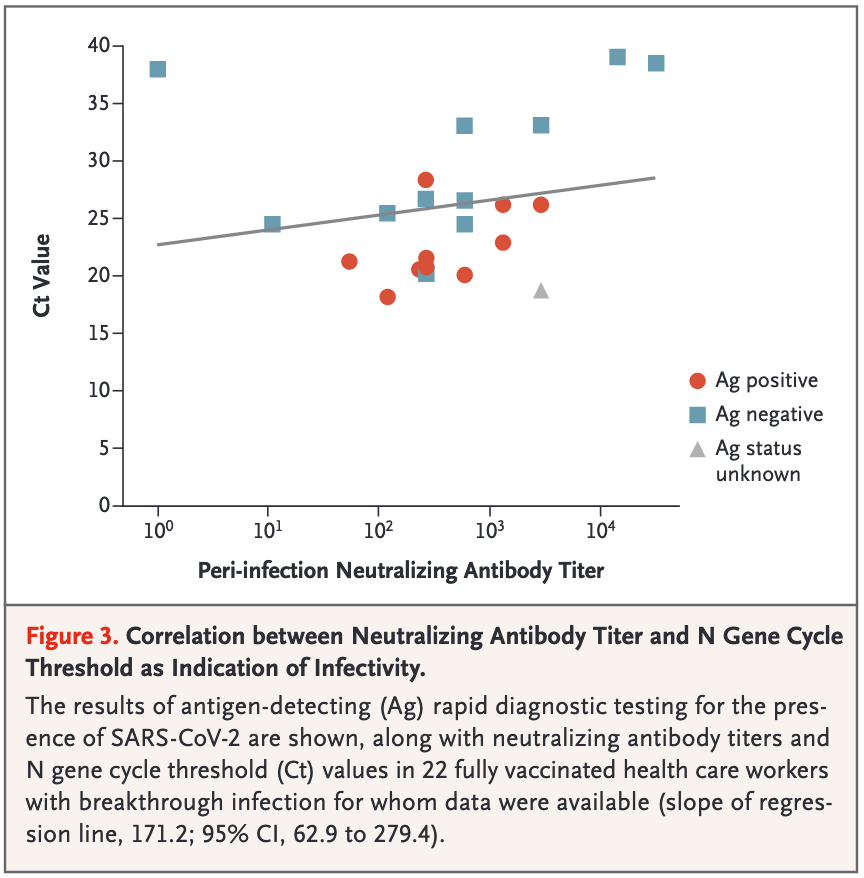
Zudem kann man auch hier ohne Viruslast-Angabe nicht sagen, ob die Nachweisgrenze (Viruslast, ab der der Test zuverlässig anschlägt) bei Geimpften eventuell höher liegt. Und (wie weiter oben beschrieben) ohne (versuchte) Virusanzucht in Zellkultur kann man ebenfalls nicht sagen, ob die Korrelation zwischen Viruslast und Ansteckungsfähigkeit (Infektiosität) bei Geimpften weiter (so stark bzw. über alle Infektionstage) gegeben ist und ob die Infektiositätsschwelle (die Viruslast, ab der man bei Ungeimpften i.d.R. Virus anzüchten kann = 10^6 RNA-Kopien/ml) bei Geimpften ähnlich ist (by the way: in der Studie von Bergwerk et al. konnten für die 39 Durchbruchsfälle - trotz teilweiser hoher Viruslast [geringe Ct-Werte] - keine Sekundärfälle festgestellt werden). Diese Information wird (auch) für die Bewertung der Aussagekraft von Antigentests bei Geimpften relevant sein. Eine weitere Limitationen der beiden Studien ist die jeweils relativ kleine Anzahl der infizierten Doppelt-Geimpften (und der jeweilige Untersuchungszeitraum vor Delta).
Fazit
Aus mehreren Studien (meist Preprints) lässt sich m.E. grundsätzlich schlussfolgern, dass mit Delta Infizierte eine höhere Viruslast aufweisen, die schneller ansteigt und eventuell auch länger andauert (jeweils im Schnitt im Vergleich zum Wildtyp und zu Alpha), und dass die Viruslast bei mit Delta infizierten Geimpften wahrscheinlich (nur) in den ersten Tagen der Infektion durchschnittlich ähnlich ist wie bei Ungeimpften, wobei asymptomatische Geimpfte wahrscheinlich im Mittel entweder durchgehend oder (noch) früher eine geringere Viruslast als symptomatische Geimpfte aufweisen. Zudem ist noch unklar, wie der Zusammenhang zwischen Viruslast und Infektiosität bei Geimpften (über den Infektionsverlauf) aussieht. Daher sollten sich m.E. (auch) Geimpfte und Genesene (weiter) proaktiv regelmäßig testen oder (kostenlos) testen lassen (können). Die Gültigkeitsdauer eines Testergebnisses sollte m.E. ggf. (auf 24 Stunden. bzw. Tagesaktualität) reduziert und die Frequenz bei regelmäßigen Screening-Tests (egal, ob per PCR-Pooling oder Antigen-Selbsttests) ggf. (auf 3x/Woche) erhöht werden. Generell müssen wir m.E. in der Erkennung Infizierter und Kontaktrückverfolgung (noch) schneller werden, so dass ein dem PCR-Test vorgeschalteter Antigen-Selbst- oder -Schnelltest für einen Zeitgewinn sorgen kann. Antigentests funktionieren laut ersten Studienergebnissen bei Delta ähnlich gut wie bei Alpha und grundsätzlich auch bei Geimpften, wobei noch unklar ist, wie zuverlässig sie bei infektiösen Geimpften sind (weil auch noch unklar ist, wann/wie lange/wie stark Geimpfte im Schnitt infektiös sind).
Autor: Christian Erdmann, FH Münster, keine Interessenkonflikte, u.a. Mitautor einer einschlägigen Meta-Analyse und Mitgründer der wissenschaftlichen Initiative RapidTests
Artikelbild: Alexandra_Koch