Letztes Update: 22.12.2023
- 1. Wie finde ich einen guten Selbsttest?
- 2. Wie wahrscheinlich ist es, dass die Sensitivität von Antigentests bei den neuen Varianten (z.B. EG.5, HV.1, BA.2.86, JN.1) beeinträchtigt ist?
- 3. Ist der Nasen- oder Rachenabstrich genauer (sensitiver)?
- 4. Wann und warum kommt es zu falsch-negativen Antigentest-Ergebnissen?
- 5. Was könnte die Sensitivität von Antigentests erhöhen?
- 6. Was sind potenzielle Gründe für falsch-positive Ergebnisse bei Antigentests?
- 7. Sind abgelaufene Antigen-Schnelltests noch zu gebrauchen?
- 8. (Wie) Kann ich anhand des Antigentest-Ergebnisses meine Viruslast abschätzen?
- 9. Wie gut sind die neuen Kombi-Schnelltests (Corona, Influenza, RSV)?
1. Wie finde ich einen guten Selbsttest?
Das Paul-Ehrlich-Institut (PEI) hat bis zum 30.05.2022 die Sensitivität (Empfindlichkeit) von 252 Antigentests (retrospektiv im Labor) untersucht (ab dem 01.06.2022 war das PEI dafür nicht mehr zuständig), wobei 204 Antigentests das Sensitivitätskriterium (≥75% bei Cq≤25 = hohe RNA-Viruslasten) erfüllten (Tabelle 1) und 48 nicht (Tabelle 2). Man findet hier eine Archivversion der PEI-Ergebnisse (vgl. auch Scheiblauer et al.).
In der 2. Spalte (von links) der Tabelle 1 sind 41 der vom PEI untersuchten Antigentests als Selbsttest gekennzeichnet (wobei es sein kann, dass einige davon heute nicht mehr als Selbsttest zugelassen sind, weil die Sonderzulassung durch das BfArM abgelaufen ist und keine CE-Zertifizierung erfolgte).
Wenn es darum geht, einen vergleichsweise guten Selbsttests zu finden, ist v.a. die Spalte "Cq ≤25" der Tabelle 1 relevant. Denn ein Cq-Wert von 25 entspricht in dem Fall etwa einer Viruslast (Konzentration) von 10^6 RNA-Kopien/mL. Diese Viruslast entspricht ca. der (bisher bekannten) "Infektiösitätsschwelle" (= RNA-Viruslast, ab der in Zellkultur mit großer Wahrscheinlichkeit "lebendes" Virus angezüchtet werden kann) (eigener Review). Da die RNA-Viruslast um so größer ist, desto kleiner der Cq-Wert (auch Ct-Wert genannt) ist, sollte der %-Wert in der Spalte "Cq ≤25" (= hohe RNA-Viruslasten) möglichst hoch sein.
Die Spalte "Cq 25-30" der Tabelle 1 ist zudem interessant. Es handelt sich zwar um (bis dato) in der Regel nicht ansteckungsfähige Viruslasten, wenn jedoch ein Antigentest in dieser Spalte höhere %-Werte als andere aufweist, spricht das dafür, dass der Test auch mittlere Viruslasten, die z.B. am Anfang der Infektion bzw. kurz vor der Ansteckungsfähigkeit vorliegen, wahrscheinlich im Schnitt gut bzw. besser als andere Tests nachweisen kann.
Tipp: Auf schnelltesttest.de gibt es sowohl einen Barcode-Scanner basierend auf der PEI-Liste (mit Stand 30.05.2022) als auch die Liste selbst mit Suchfunktion.
Noch zwei Hinweise zu den PEI-Ergebnissen:
1. Aus retrospektiven Studien sollten keine klinischen (realen) Sensitivitäten von Antigentests abgeleitet werden. Diese dienen v.a. dazu, die Sensitivität verschiedener Antigentests unter möglichst identischen Bedingungen miteinander zu vergleichen (siehe Diskussion in Bekliz et al.).
2. Die Antigentests wurden nicht mit Speichelproben untersucht. Wahrscheinlich sind die vom PEI mittels Nasen-Rachen- und Rachen-Proben ermittelten Sensitivitäten trotzdem auf die in der PEI-Tabelle gelisteten Antigentests mit Speichelproben (Spuck- und Lollitests) übertragbar, weil auch bei Speichelproben die RNA-Viruslast (der Ct-Wert) mit der Antigen(N-Protein)-Konzentration zusammenhängt (je höher die RNA-Viruslast bzw. niedriger der Ct-Wert, desto höher die N-Protein-Konzentration und somit die Sensitivität des Antigentests) (siehe z.B. Asai et al., Basso et al., Ren et al., Yokota et al.). ABER: Die RNA-Viruslast und damit auch die Antigen-Konzentration im Speichel ist wahrscheinlich im Schnitt nur für einen vergleichsweise kurzen Zeitraum ausreichend, damit Spuck- und Lollitests zuverlässig (zu ≥90% im Vergleich zum PCR-Test) anschlagen können (siehe dazu ausführlicher unter Frage 4).
Für Interessierte:
1. Im Anhang 1 der gemeinsamen Liste von Corona-Antigen-Schnelltests des Gesundheitssicherheitsausschuss der Europäischen Union (die ein letztes Mal am 26.07.2023 aktualisiert wurde) befinden sich Antigentests, die in unabhängigen (prospektiven und/oder retrospektiven) Studien mind. eine Gesamtsensitivität von 80% oder mind. eine Sensitivität von 90% bei hohen Viruslasten (Ct<25) erreichten, jedoch sind darin keine Selbsttests und Antigentests, die ausschließlich für Speichelproben zugelassen sind, enthalten.
2. Einen aktuellen systematischen Review mit Meta-Analyse einschlägiger unabhängiger (prospektiver und retrospektiver) Studien zu Antigentests mit Selbstabstrich bzw. Selbsttests findet man hier.
2. Wie wahrscheinlich ist es, dass die Sensitivität von Antigentests bei den neuen Varianten (z.B. EG.5, HV.1, BA.2.86, JN.1) beeinträchtigt ist?
Letztes Update: 22.12.2023
(Analytische und retrospektive) Laborstudien und (prospektive) klinische (Real-Life-)Studien weisen insgesamt auf keine merklich veränderte (analytische und klinische) Sensitivität der allermeisten Antigentests bei Omikron und den Omikron-Subvarianten BA.1, BA.1.1, BA.2, BA.2.21, BA.4 und BA.5 (im Vergleich zum "Wildtyp" und vorherigen Varianten) hin, sofern man die Studien-Ergebnisse v.a. nach RNA-Viruslast, Immunisierungsstatus, Abstrichart und Testzeitpunkt differenziert (siehe dazu z.B. hier). Dies ist m.E. nicht verwunderlich, da bei diesen Varianten nur vereinzelt neue oder keine neuen Mutationen im N-Protein (= Antigen, auf das nahezu alle Antigentests testen) im Vergleich zu den jeweiligen vorherigen Varianten vorlagen.
Für die Omikron-Subvarianten BA.2.75, BQ.1, BQ.1.1, BF.7, XBB.1, XBB.1.5 ("Kraken"), JN.1/2/3/5 liegen bisher nur (analytische und retrospektive) Laborstudien vor (Anderson et al., Bekliz & Eckerle, Mackenzie et al., Sakai-Tagawa et al., Okada et al., Osterman et al., Vaeth et al. (a)), die (direkt) zeigen oder (indirekt) darauf hindeuten, dass die (analytische) Sensitivität der darin untersuchten Antigentests ähnlich (nicht signifikant unterschiedlich) wie bei den vorherigen Varianten ausfällt.
Studien zur Sensitivität von Antigentests bei den Omikron-Subvarianten XBB.1.16 ("Arcturus"), EG.5 ("Eris"), EG.5.1, HV.1 und BA.2.86 ("Pirola") liegen m.W. noch nicht vor.
Die laut RKI aktuell (in KW48 2023) in Deutschland überwiegenden Varianten EG.5 (inkl. EG.5.1 und HV.1) und BA.2.86 (inkl. JN.1) besitzen laut CoV-Spectrum (Stand 22.12.2023) keine (EG.5, EG.5.1 und HV.1) oder nur eine (BA.2.86 und JN.1) neue (bisher unbekannte) Mutation im N-Protein (= Antigen, auf das nahezu alle Antigentests testen).
Es ist m.E. unwahrscheinlich, dass die neue Mutation (Austausch der Aminosäure Glutamin mit der Aminosäure Lysin an Position 229) im N-Protein von BA.2.86 und JN.1 die analytische Sensitivität (Nachweisgrenze = kleinste Antigen-Konzentration, die vom jeweiligen Antigentest noch zuverlässig [zu 95-100%] nachgewiesen werden kann) der allermeisten Antigentests beeinträchtigt, weil..
- die Mutation an einer Position in der sogenannten "linker region" des N-Proteins befindet, an der 406 von 428 Antigentests, deren Testdesign (Antikörper) dem Paul-Ehrlich-Institut (PEI) mit Stand 24.03.2022 bekannt war, nicht (mit ihren Antikörpern) binden. Für die restlichen 22 Antigentests war dem PEI die genaue Binderegion (der Antikörper) nicht bekannt, wobei davon wahrscheinlich, wenn überhaupt, nur ein Bruchteil an der mutierten Position bindet (siehe bestätigend Frank et al.).
- es zudem m.E. unwahrscheinlich ist, dass sich durch diese spezielle Mutation die räumliche Struktur (Konformation) des N-Proteins derart geändert hat, dass die Antikörper der allermeisten Antigentests weniger effizient an das N-Protein binden können (siehe bestätigend Frank et al.).
- in einer retrospektive Laborstudie der darin untersuchte Antigentest JN.1/2/3/5-Proben mit hohen Viruslasten (Ct<24) zu 92,5% erkannt hat (Bekliz & Eckerle).
Bei EG.5/EG.5.1/HV.1 liegt - wie bereits erwähnt - wiederum keine neue Mutation im N-Protein vor (wie übrigens auch bei XBB.1/XBB.1.5/XBB.1.16), so dass es auch hier m.E. jeweils unwahrscheiblich ist, dass die analytische Sensitivität der allermeisten Antigentests beeinträchtigt ist.
Ergo: Die Antigen(N-Protein)-Konzentration, die in der Probe mindestens vorliegen muss, damit der Antigentest zuverlässig anschlägt, wird für die allermeisten Antigentests bei den neuen o.g. Varianten m.E. wahrscheinlich unverändert sein.
Die klinische Sensitivität (Wahrscheinlichkeit, dass ein Antigentest eine infizierte Person erkennt, i.d.R. im Vergleich zum PCR-Test bestimmt) ist vom Testzeitpunkt abhängig (weil sich die RNA-Viruslast und damit die Antigen-Konzentration im Infektionsverlauf ändert) und könnte unabhängig von der analytischen Sensitivität bei einer neuen Variante (je nach Testzeitpunkt) reduziert sein.
So könnte bei einer neuen Variante der Zeitraum am Anfang der Infektion, in dem die Nachweisgrenze des Tests noch unterschritten ist, im Schnitt länger werden (sprich: die Antigen-Konzentration könnte z.B. in der Nase im Schnitt langsamer ansteigen, falls die damit korrelierende RNA-Viruslast ebenfalls im Schnitt langsamer ansteigen oder das Verhältnis von Antigen- zu RNA-Konzentration im Schnitt kleiner werden würde), so dass Antigentests im Infektionsverlauf erst im Schnitt etwas später zuverlässig (zu ≥90% im Vergleich zum PCR-Test) anschlagen würden.
Davon unabhängig könnte die minimale Infektionsdosis bei einer neuen Variante geringer sein, wodurch die Erkennungsrate infektiöser Personen (am Anfang der infektiösen Phase) wahrscheinlich reduziert wäre.
Aber: Theoretisch wäre es aber auch möglich, dass die klinische Sensitivität bei einer neuen Variante (je nach Testzeitpunkt) höher ausfällt.
Für die neuesten (Sub-)Varianten liegen jedoch - wie oben erwähnt - noch keine (prospektiven) klinischen (Real-Life-)Studien vor.
Good to know: Von einem möglichen Varianteneinfluss unabhängig ist die klinische Sensitivität (im Vergleich zum PCR-Test) nun um den Symptombeginn herum offensichtlich bedingt durch einen früheren Symptombeginn bei Vorimmunisierten wahrscheinlich im Schnitt verringert (siehe dazu ausführlicher unter Frage 4).
Für Interessierte: In der Publikation von Frank et al. wird eine Methode beschrieben, mit der sogenannte Escape-Mutationprofile (in der Art eines Fingerabdrucks) für die in den jeweiligen SARS-CoV-2-Antigentests genutzten monoklonalen Antikörper erstellt werden können, mit denen man in der Folge bei allen zukünftigen SARS-CoV-2-Varianten relativ gut/genau voraussagen kann bzw. könnte, ob die ggf. neuen Mutationen im N-Protein (Antigen) der neuen Variante die analytische Sensitivität des jeweiligen Antigentests beeinträchtigen werden.
3. Ist der Nasen- oder Rachenabstrich genauer (sensitiver)?
Vorab: Dies stellt keine Empfehlung dar, Schnell-/Selbsttests abweichend von der Gebrauchsanweisung zu verwenden (v.a. weil das Stäbchen einiger nicht für den Rachenabstrich vorgesehener Tests mitunter zu kurz und/oder zu unflexibel ist, um ordentlich in/an den Rachen zu kommen).
Die Human-Challenge-Studie mit dem "Wildtyp" (Killingley et al.) und andere Längsschnittstudien (Lin et al., Winnett et al. (a)) mit Omikron (BA.1, BA.1.1) lassen vermuten, dass das SARS-CoV-2-Virus generell zwar im Schnitt etwas früher im Rachen per PCR-Test, aber im Schnitt nicht merklich früher per Antigentest nachweisbar ist (so kann es sein, dass mal der Nasen- und mal der Rachenabstrich beim Antigentest früher anschlägt).
ABER: Ein kombinierter Rachen- und Nasen(selbst)abstrich zeigte in einzelnen klinischen (Real-Life-)Studien bei Omikron (BA.1, BA.1.1), aber auch bereits beim "Wildtyp", eine im Schnitt um ca. 5-20%-Punkte erhöhte Gesamt-Sensitivität im Vergleich zum alleinigen Nasen(selbst)abstrich (Goodall et al., Schrom et al., Schuit et al. (a), Zwart et al., vgl. auch Killingley et al.).
Ferner sprechen die vorgenannten Studien dafür, dass der alleinige Nasen(selbst)abstrich über den gesamten Infektionsverlauf gesehen beim Schnelltesten via Antigentest im Schnitt sensitiver als der alleinige Rachen(selbst)abstrich ist (sofern man sich also entscheiden muss, ist m.E. der Nasenabstrich vorzuziehen).
4. Wann und warum kommt es zu falsch-negativen Antigentest-Ergebnissen?
Grundsätzlich ist bekannt, dass die Nachweisgrenze (analytische Sensitivität) der meisten Antigentests im oder um den Bereich der (bisher bekannten) "Infektiositätsschwelle" (= RNA-Viruslast, ab der in Zellkultur mit großer Wahrscheinlichkeit "lebendes" Virus angezüchtet werden kann) herum liegt (z.B. Cubas Atienzar et al., Deerain et al., Kontogianni et al. i.V.m. eigenem Review). Das heißt einerseits, dass die meisten Antigentests gut (wenn auch nicht perfekt) bei hohen, potenziell ansteckungsfähigen RNA-Viruslasten anschlagen (siehe z.B. Brümmer et al., eigener Review). Andererseits kommt es daher bei geringen bis mittleren, i.d.R. jedoch nicht ansteckungsfähigen RNA-Viruslasten meist zu falsch-negativen Ergebnissen (im Vergleich zum PCR-Test). Während Letzteres nach hinten raus (wenn man nicht mehr ansteckend ist) weitgehend irrelevant ist, kann ein falsch-negatives Ergebnis im Viruslast-Anstieg (wenn man noch nicht ansteckend ist) eine falsche Sicherheit bedeuten. Auch wenn Antigentests ein gutes Tool darstellen, um Positive bzw. potenziell Ansteckende zu entdecken, sollte daher bzw. generell bitte beachtet werden, dass ein negativer Antigentest nie eine Infektion ausschließen kann!
Was sind weitere (Hinter-)Gründe für falsch-negative Ergebnisse bei Antigentests?
- Bei Vorimmunisierten (durch Impfung und/oder Infektion) beginnen die Symptome aufgrund der schnelleren Immunreaktion im Schnitt offensichtlich früher (siehe Diskussionen in Landon et al. und Meiners et al.). Dafür spricht laut Christian Drosten auch, dass die Inkubationszeit (= Zeit von Ansteckung bis Symptombeginn) mit zunehmenden Immunisierungsgrad abgenommen hat (Wu et al.). Dementsprechend zeigte sich in Studien, dass der Viruslast-Peak (Gipfel) bei Geimpften im Schnitt erst nach Symptombeginn auftrat (Frediani et al., Kandel et al., Hay et al., Marking et al., Takahasi et al., Townsley et. al., Winnett et al. (a), Winnett et al. (b)). Dadurch kommt es (laut Christian Drosten und Michael Mina) in den ersten Tagen nach Symptombeginn bei Geimpften/Genesenen wahrscheinlich häufig(er) zu falsch-negativen Ergebnissen, weil die RNA-Viruslast bzw. die Antigen-Konzentration noch nicht hoch genug (oft noch nicht ansteckend) ist. Daher bitte trotz negativem Antigentest bei bzw. kurz nach Symptombeginn in den nächsten Tagen weiter testen!
- Bei Vorimmunisierten ist die Sensitivität der Antigentests bezogen auf dieselbe RNA-Viruslast möglicherweise im Schnitt geringer als bei Immunnaiven (siehe v.a. Studiengrafik 5B in Meiners et al.). Eine mögliche Erklärung (von Victor Corman) dafür ist, dass bei Vorimmunisierten wahrscheinlich weniger Zellen infiziert werden (vgl. Mostaghimi et al.), wodurch die Antigen-Konzentration im Verhältnis zur RNA-Konzentration stärker abnehmen würde*. Damit zusammenhängend sind vollständig Geimpfte/Geboosterte und Genesene jedoch wahrscheinlich gleichzeitig für wenige Monate nach der letzten Impfung/Infektion im Schnitt weniger/seltener/kürzer ansteckend als Immunnaive (Real-Life-Studien: Madewell et al., Sun et al., Tan et al.; Laborstudien: Puhach et al., Peña-Hernández et al., Hakki et al., Garcia-Knight et al.). Abgesehen von einer potenziellen (eher kleinen) "Sensitivitätslücke" zu Beginn der Infektiosität (siehe unten) sollten Antigentests also auch bei Geimpften/Geboosterten bei potenzieller Ansteckungsfähigkeit gut (zu 85-95%) anschlagen (vgl. Cosimi et al., Luna-Muschi et al.).
*Hintergrund: Das Verhältnis von N-Protein (= Antigen, auf das fast alle Antigentests testen) zu RNA fällt in infizierten Zellen wahrscheinlich zugungsten von N-Protein aus. Auch wenn der RNA-Viruslast-Peak bei Geimpften und Ungeimpften (mittlerweile) ähnlich ist, ist (neben der Fläche unter der infektiösen Viruslast-Kurve auch) die Fläche unter der RNA-Viruslast-Kurve (AUC) bei Geimpften wahrscheinlich kleiner (Garcia-Knight et al., Kissler et al., Hakki et al., Hay et al.). Dafür, dass bei infizierten Geimpften weniger (freies) N-Protein verfügbar ist, spricht laut Victor Corman, dass hier auch die Konzentration der gegen das N-Protein gerichteten Antikörper geringer ausfällt (Whitaker et al., Follmann et al., Scurr et al.). - Es ist gut möglich, dass die Sensitivität der Antigentests bezogen auf dieselbe RNA-Viruslast am Anfang der Infektion noch geringer ist als im weiteren Verlauf der Infektion (siehe v.a. Studiengrafik 5A in Meiners et al.). Eine mögliche Erklärung (von Christian Drosten) für diese "Sensitivitätslücke" ist, dass es anfangs wahrscheinlich noch nicht genug infizierte, abgestorbene Schleimhautzellen, die mit N-Protein beladen sind, gibt* (siehe Diskussion in Meiners et al.). In Verlaufsstudien (Längsschnittstudien) mit Ungeimpften ("Wildtyp"/Pre-Alpha, Alpha, Delta) und Geimpften (Delta), wo täglich Proben für den PCR-Test, den Antigentest und die Viruskultur (Virusanzucht) genommen wurden, schlugen die Antigentests immerhin im Schnitt(!) erstmals innerhalb der ersten 24 Stunden nach dem erstmaligen Nachweis von "lebendem" Virus an (Hakki et al., Killingley et al., Ke et al., Smith et al.). Die anfängliche infektiöse Phase ("Sensitivitätslücke"), die die Antigentests also grundsätzlich verpassen (würden), dürfte im Schnitt wahrscheinlich eher ≤24 Stunden als mehrere Tage betragen. Zwei Studien von Soni et al. und Winnett et al. (a) mit Selbsttests deuten zumindest darauf hin, dass das bei Omikron (BA.1, BA.1.1) und Geimpften (bezogen auf die Erkennung von potenziell infektiösem Virus in der Nase) nicht wesentlich anders ist.
*Hintergrund: Aus abgestorbenen (nicht mehr intakten) Zellen wird wahrscheinlich mehr N-Protein (Antigen) detektierbar sein als aus infizierten, aber noch intakten (lebenden) Zellen, oder Virionen, die erst durch den Lysepuffer des Antigentests "aufgebrochen" werden müssen. - Da sich die Viruskinetik (zeitlicher Verlauf der RNA-Viruslast) in Nasenrachen (Nasopharynx), Mundrachen (Oropharynx), Nase und Speichel offenbar unterscheidet ("Wildtyp": Killingley et al., Alpha: Ke et al., Omikron: Cornette et al., Lin et al., Winnett et al. (a), Winnett et al. (b)) kann es sein, dass die RNA-Viruslast bzw. die Antigen-Konzentration in einem Kompartiment bereits (oder noch) ausreichend ist, damit der Antigentest anschlägt, in einem anderen aber noch nicht (oder nicht mehr). Ein kombinierter Rachen- und Nasenabstrich z.B. erhöht dementsprechend die Sensitivität der Antigentests im Schnitt um ca. 5-20%-Punkte (siehe dazu ausführlicher unter Frage 3). Wichtig: Die RNA-Viruslast und damit auch die Antigen-Konzentration im Speichel ist wahrscheinlich oft nicht bzw. im Schnitt nur für einen relativ kurzen Zeitraum ausreichend (Cornette et al., Golden et al., Ke et al., Lai et al., Lin et al. Kritikos et al., Savela et al., Winnett et al. (a), Winnett et al. (b)), damit die bei uns als Selbsttest erhältlichen Spuck- und Lollitests zuverlässig (zu ≥90% im Vergleich zum PCR-Test) anschlagen können (siehe für Omikron z.B. de Meyer et al.).
- Christian Drosten wies darauf hin, dass es (wahrscheinlich ähnlich wie bei Influenza) bei bereits (Mehrfach)Infizierten sein könnte, dass Antikörper in der abgenommenen (Nasen-)Probe, die sich gegen das N-Protein (Antigen) richten (und nach Infektion, nicht nach Impfung mit mRNA- oder Vektorimpfstoffen gebildet werden!), die Testreaktion stören könnten, indem sie die Bindungsstellen (Epitope) im N-Protein für die (das Antigen nachweisenden) Antikörper der Antigentests teils belegen. Zwar wurde in einzelnen Studien eine im Schnitt (mal mehr, mal weniger) geringere (Gesamt-)Sensitivität von Antigentests bei vorher Infizierten festgestellt (Schuit et al. (a), Schuit et al. (b), Venekamp et al.), jedoch wurde in keinem Fall nach RNA-Viruslast (oder gar Viruskultur-Positivität) differenziert, so dass die Daten nicht aussagefähig zur Überprüfung der Hypothese sind (das merkt man schon daran, dass in einem Fall die Gesamt-Sensitivität bei vorher Infizierten im Schnitt sogar höher war).
- In einem späten Stadium der (akuten) Infektion kommt es häufig(er) vor, dass man trotz hoher RNA-Viruslast in Folge neutralisierender Antikörper (nicht nur durch ggf. vorherige Infektion und/oder Impfung, sondern auch durch die aktuelle Infektion induziert) nicht mehr ansteckend ist, so dass Antigentests nicht mehr anschlagen (siehe z.B. van Kampen et al. i.V.m. Ke et al., Luna-Muschi et al.).
- Die Abstrichqualität spielt ebenfalls, aber m.E. eine weniger große Rolle als anfangs befürchtet - zumindest bezogen auf den vorderen Nasenabstrich, der für sich genommen bereits eine relativ gute Sensitivität bei hohen RNA-Viruslasten aufweist (Brümmer et al., Karlafti et al.), weil diesen selbst Kinder relativ zuverlässig selbstständig durchführen können (Altamirano et al., Cohen et al., Engels et al., Waggoner et al.). Aber auch der Rachen-Selbstabstrich wird von Erwachsenen meist korrekt durchgeführt (García-Fiñana et al., Goodall et al., Schuit et al. (a), Shakir et al.).
5. Was könnte die Sensitivität von Antigentests erhöhen?
- Gebrauchsanweisung lesen und einhalten (z.B. alle Testkomponenten ggf. vorher auf Raumtemperatur bringen, an Ablesezeit halten, etc.).
- Sofern kein Strich bei der T-Linie zu erkennen ist: Test unter helles Licht halten, Lupe nutzen, Test fotografieren und mit (Foto-)App Helligkeit verringern, Kontraste erhöhen und Schwarz-Weiß-Modus wählen (Beispiel 1, Beispiel 2, Beispiel 3).
- Sofern ein ganz leichter Strich (Hauch) bei der T-Linie zu erkennen ist (entweder mit bloßem Auge oder nach Anwendung der zuvor genannten Maßnahmen), Test als positiv interpretieren.
- Regelmäßige Tests erhöhen die Wahrscheinlichkeit, eine infizerte Person zu entdecken (z.B. Smith et al., Lind et al., Schultes et al., Chu et al., Richardson et al.). V.a. nach Symptomeintritt ist es ratsam, mehrere Tage hintereinander zu testen, weil die RNA-Viruslast bzw. Antigen-Konzentration offensichtlich insbesondere bei Vorimmunisierten oft erst nach Symptombeginn die Nachweisgrenze der Tests erreicht (siehe dazu ausführlicher unter Frage 4).
- Rachen- und Nasenabstrich kombinieren (siehe dazu ausführlicher unter Frage 3). JEDOCH: Keine allgemeine Empfehlung, weil das Stäbchen einiger nicht für den Rachenabstrich vorgesehener Tests mitunter zu kurz und/oder zu unflexibel ist, um ordentlich in/an den Rachen zu kommen!
- Stäbchen länger (ca. 5 Minuten) in der Pufferlösung lassen. Der Lysepuffer dient u.a. dazu, noch intakte (lebende) Schleimhautzellen und Virionen "aufzubrechen", wodurch (noch nicht) freies Antigen detektierbar wird. Bei einer längeren Inkubations(einwirk)zeit für den Lysepuffer ist zu erwarten, dass (im Schnitt) mehr Zellen aufgeschlossen werden. Bei einigen (wenigen) Tests werden 5 Minuten Einwirkzeit empfohlen, bei den meisten jedoch weniger (oft ≤1 Minute), wobei meiner Information nach einige Hersteller die Einwirkzeit reduziert haben (zugunsten eines Zeitgewinns, aber evtl. auf (minimale) Kosten der durchschnittlichen Sensitivität). JEDOCH: Bisher rein theoretischer Gedanke, denn untersucht wurde das bislang m.W. nicht!
- Wenn der Test nach der empfohlenen Ablesezeit negativ war, dann das Testergebnis noch mal nach ein paar Stunden ablesen (nachdem der Test weiter bei Raumtemperatur gelagert wurde!). Sofern er dann leicht positiv ist, als positiv werten (bei Verdacht sollte man aber sowieso spätestens am nächsten Tag erneut testen, siehe oben). JEDOCH: Keine Empfehlung; basiert nur auf anekdotischer Evidenz; wäre nur bei hoher Vortestwahrscheinlichkeit/bei Verdacht sinnvoll und wenn man denselben Antigentest bereits öfters genutzt hat und er dabei nach ein paar Stunden nicht falsch-positiv wurde, denn einige Tests neigen dazu, beim Austrocknen falsch-positiv zu werden (siehe unter Frage 6)!
6. Was sind potenzielle Gründe für falsch-positive Ergebnisse bei Antigentests?
Vorab: Beim asymptomatischen Screening mit Antigentests ist im Schnitt wahrscheinlich (nur) ca. einer von 1000 durchgeführten Antigentests falsch-positiv (= Spezifität von ca. 99,9%) (eigener Review). Je nach Vortestwahrscheinlichkeit (Wahrscheinlichkeit, dass eine Person infiziert ist, die v.a. von Inzidenz, Symptomstatus und Kontaktverhalten abhängig ist) ist die Wahrscheinlichkeit, dass ein positiver Antigentest falsch-positiv ist, jedoch unterschiedlich (je höher die Vortestwahrscheinlichkeit, desto geringer die Wahrscheinlichkeit eines falsch-positiven Ergebnisses). Bei hohen Inzidenzen (also höherer Vortestwahrscheinlichkeit) - wie z.B. im Herbst/Winter üblich - liegt die Wahrscheinlichkeit eines falsch-positiven Ergebnisses (bei Vorliegen eines positiven Antigentests) im Schnitt nur im Bereich von ca. 10-25% (Freund et al.).
Als potenzielle Gründe für falsch-positive Ergebnisse bei Antigentests sind bekannt oder werden diskutiert:
- Fehlerhafte Charge (Gans. et al.)
- Hohe Temperaturen: >30°C über einen längeren Zeitraum (z.B. durch lange Sonneneinstrahlung) (siehe Diskussion in Abdul-Mumin et al.)
- Niedrige Temperaturen: Ein schneller Temparaturwechsel von Raumtemperatur hin zu kälteren Temperaturen direkt vor dem Testen (z.B. wenn man im Winter für die Test-Durchführung nach draußen geht; nur das Durchführen des Abstriches draußen wäre dagegen okay) (Haage et al.). Eine Kühllagerung an sich scheint dagegen unproblematisch zu sein (Haage et al.), so dass viele Hersteller eine Lagerung bei 2-30°C empfehlen, jedoch sollten alle Testkomponenten (Testkassette, Pufferlösung) vor der Test-Durchführung für mindestens 30 Minuten auf Raumtemperatur (15-30°C) gebracht werden.
- Kreuzreaktionen mit anderen Viren (z.B. Otake et al., Blairon et al.)
- Persistierender Wirtsfaktor in der Nasenschleimhaut (z.B. Staphylokokken) (Hoehl et al.)
- Essen und Trinken vor dem Test (gilt v.a. für Speichel-, Wangen- und Rachenproben) (vgl. Velavan et al., Patriquin et al.)
- Testergebnis wird (deutlich) später als nach der vorgegebenen Ablesezeit abgelesen: Einige Antigentests neigen beim Austrocknen dazu, falsch-positiv zu werden (Paul et al.).
Hinweis: Die Wahrscheinlichkeit eines falsch-positiven Ergebnisses lässt sich offensichtlich (im Schnitt) noch verringern, wenn man nach einem positiven Antigentest ein zweites Mal mit demselben Test (Connor et al., Peto et al.) oder - noch besser (weil die Tests oft unterschiedliche Antikörper und Pufferlösungen verwenden) - mit einem Antigentest eines anderen Herstellers (vgl. Corman et al., Blairon et al.) (nach)testet - v.a. im letzteren Fall sollte der zweite Test jedoch erst einige Stunden nach dem ersten Test oder am nächsten Morgen erfolgen (wobei man sich bis dahin isolieren sollte), weil es sein könnte, dass der zweite/andere Antigentest eine höhere Nachweisgrenze (also geringere analytische Sensitivität) hat und daher im Infektionsfall erst etwas später als der erste Test anschlagen würde. JEDOCH: Keine Empfehlung! Das würde auch nur bei geringer Vortestwahrscheinlichkeit sinnvoll sein, die z.B. im Herbst/Winter wahrscheinlich selten vorliegt.
7. Sind abgelaufene Antigen-Schnelltests noch zu gebrauchen?
Grundsätzlich ist es m.E. nicht empfehlenswert, abgelaufene Antigen-Schnelltests zu nutzen.
Aber: Gemäß zweier (analytischer) Studien (Vaeth et al. (a), Vaeth et al. (b)) und von einigen Test-Herstellern gegenüber der FDA (US-Behörde für Lebens- und Arzneimittel) vorgelegter Daten (aus weiterführenden Stabilitätsstudien) bleiben die Sensitivität und die Spezifität der in den Studien untersuchten Antigen-Schnelltests (bei Lagerung gemäß Gebrauchsanweisung!*) für - je nach Test - 4 bis 12 Monate nach dem aufgedruckten Haltbarkeitsdatum (genauer: Verfallsdatum) nahezu unverändert. Man sollte jedoch m.E. nicht davon ausgehen, dass das auf alle Antigentests übertragbar ist (entscheidend dürfte das jeweilige Herstellungsdatum sein).
*Viele Hersteller empfehlen eine Lagerung bei 2-30°C, wobei davon auszugehen ist, dass bei einer kühleren Lagerung (Kühlschrank-Temperaturen) der Test länger haltbar ist. Wichtig: Im Falle einer Kühlschrank-Lagerung sollten alle Testkomponenten (Testkassette, Pufferlösung) vor der Test-Durchführung für mindestens 30 Minuten auf Raumtemperatur (15-30°C) gebracht werden (siehe unter Frage 6)!
Tipp: Auch für einige in Deutschland erhältliche Antigen-Schnelltests/Selbsttests liegen der FDA Hersteller-Daten zu einer verlängerten Haltbarkeit vor. Einfach hier in der Tabelle nachschauen und ggf. auf den neben dem entsprechenden Test stehenden Link "Extended Expiration Date" klicken und nach der Chargennummer des vorliegenden Tests suchen (wobei es sein könnte, das dort nur Chargennummern für in den USA vertriebene Chargen aufgeführt sind).
Hinweis: Bei einigen Tests kommt es vor, dass auf den einzeln verpackten Test-Komponenten (Testkassette, Pufferlösung, Stäbchen) Haltbarkeitsdaten aufgedruckt sind, die jeweils weiter in der Zukunft liegen als das auf der Außenverpackung gedruckte Haltbarkeitsdatum (Beispiel 1, Beispiel 2). Dies steht im Einklang mit den o.g. weiterführenden Stabilitätsstudien einiger Hersteller, die eine verlängerte Haltbarkeit als ursprünglich/vorläufig (experimentell) bestimmt zeigen. Am anfälligsten sind laut PEI die (chemische) Pufferlösung und die Testkassette (die die Antikörper enthält). Ist eines der darauf aufgedruckten Haltbarkeitsdaten abgelaufen, sollte der Test nicht mehr verwandt werden (außer der Hersteller weist für die Chargennummer des vorliegenden Tests eine verlängerte Haltbarkeit aus)!
Falls ein abgelaufener Test genutzt wurde (z.B. weil kein Geld für einen neuen verfügbar ist) und die Kontrolllinie nur noch schwach erscheint, spricht das für eine Qualitätsminderung des Tests. Sollte jedoch das Ergebnis positiv sein, ist es (gerade bei hoher Vortestwahrscheinlichkeit z.B. im Herbst/Winter) wahrscheinlich, dass der Test richtig-positiv ist (selbst wenn die Kontrolllinie nur noch schwach erscheint), während ein negatives Test-Ergebnis bei einem abgelaufen Test (ohne ausgewiesener Halbarkeitsverlängerung durch den Hersteller) Michael Minas und auch meiner Meinung nach nicht mehr vertrauenswürdig ist.
8. (Wie) Kann ich anhand des Antigentest-Ergebnisses meine Viruslast abschätzen?
Vorab: Bei den im Einzelhandel erhältlichen Antigentests handelt es sich um qualitative Tests, die nur für eine ja/nein-Antwort ("bin ich wahrscheinlich infiziert bzw. infektiös oder nicht?") konzipiert sind.
Aber: Laut Studien korreliert die Zeit bis zum Erscheinen des positiven Test-Ergebnisses (der Test-Linie) negativ mit der RNA-Viruslast und der Antigen(N-Protein)-Konzentration (Abusrewil et al., Akashi et al., Iglὁi et al., Morinaga et al., Salvagno et al. (a), Salvagno et al. (b), Salvagno et al. (c)). Sprich (im Schnitt gilt): Je schneller das positive Ergebnis (die T-Linie) erscheint, desto höher die Viruslast (niedriger der Ct-Wert) und Antigen-Konzentration.
Laut Studien korreliert zudem die Farb-Intensität der T-Linie (= positives Test-Ergebnis) positiv mit der RNA-Viruslast und der Antigen(N-Protein)-Konzentration (Abusrewil et al., Golden et al., Hussain et al., Iglὁi et al., Lee et al., Petonnet et al., Pilarowski et al., Routsias et al., Salcedo et al., Schwob et al., Strömer et al.). Sprich (im Schnitt gilt): Je intensiver (dunkler) die T-Linie (nach der 15-minütigen Wartezeit), desto höher die Viruslast (niedriger der Ct-Wert) und Antigen-Konzentration.
Man kann also sehr grob die RNA-Viruslast (Konzentration) über die Zeit bis zum Erscheinen der T-Linie und über die Farb-Intensitivät der T-Linie abschätzen. Die RNA-Viruslast korreliert wiederum positiv mit der Wahrscheinlichkeit, ansteckend (infektiös) zu sein (bzw. mit der Wahrscheinlichkeit, "lebendes" Virus in Zellkultur anzüchten zu können) (Huang et al., Jones et al., Korenkov et al., Pekosz et al., Shamier et al., van Beek et al., van Kampen et al., Wölfel et al.). Sprich (im Schnitt gilt): Je höher die RNA-Viruslast (niedriger der Ct-Wert), desto höher die Wahrscheinlichkeit, infektiös zu sein.
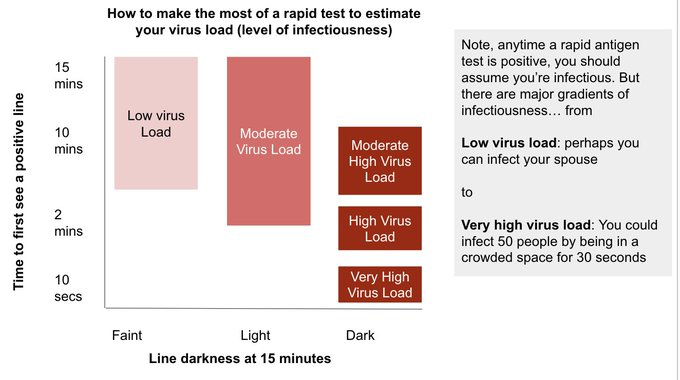
ACHTUNG:
1. Wie unter Frage 4 erläutert, kann ein negativer Antigentest nie eine Infektion ausschließen kann! Sprich: Ein negativer Antigentest könnte z.B. bedeuten, dass die RNA-Viruslast bzw. Antigen-Konzentration nicht bzw. noch nicht oder nicht mehr ausreichend ist, damit der Antigentest anschlägt.
2. Andersherum bedeutet ein (richtig-)positives Antigentest-Ergebnis meist, dass man infektiös ist (z.B. Iglὁi et al., Pekosz et al.), weil die Nachweisgrenze der meisten Antigentests im oder um den Bereich der (bisher bekannten) "Infektiositätsschwelle" liegt (siehe ebenfalls unter Frage 4). Daher sollte bei einem positiven Antigentest immer davon ausgegangen werden, dass eine Ansteckungsfähigkeit vorliegt - selbst, wenn die T-Linie nur hauchdünn und/oder relativ langsam erscheint.
3. Je nach Charge des Antigentests kann es sein, dass die Zeit bis zum Erscheinen des positiven Ergebnisses und die Farbintensität trotz identischer RNA-Viruslast bzw. Antigen-Konzentration etwas variiert (Pilarowski et al.). Auch deswegen ist mittels Antigentests auch nur eine sehr grobe Abschätzung der Viruslast möglich.
4. Sofern man den Viruslast-Verlauf (grob) abschätzen will, sollte das Antigentest-Modell, die den Test durchführende Person und die Abstrichart bei jedem Test möglichst identisch sein.
9. Wie gut sind die neuen Kombi-Schnelltests (Corona, Influenza, RSV)?
Kombi-Antigen-Schnelltests für SARS-CoV-2, Influenza A und Influenza B: In (retrospektiven) Laborstudien und (prospektiven) klinischen (Real-Life-)Studien lag die Sensitivität der 8 untersuchten Kombi-Schnelltests bei hohen Viruslasten (niedrigen Ct-Werten) für SARS-CoV-2, Influenza A und Influenza B meist jeweils bei ≥85%* und die (Gesamt-)Spezifität für die 3 Viren meist jeweils bei 99-100%, wobei sowohl die Gesamt-Sensitivität als auch die Sensitivität bei hohen Viruslasten im Schnitt für SARS-CoV-2 größer als für Influenza A und für Influenza A wiederum größer als für Influenza B ausfielen (Takeuchi et al., Ellis et al., Dinç et al., Widyarasi et al., Lim et al., Lei et al., van der Moeren et al.).
*Bei einem Kombi-Schnelltest lag die Sensitivität für Influenza B nur bei 33,3% (Dinç et al.), was etwas verwundert, weil für denselben Test in einer anderen Studie die analytische Sensitivität für SARS-CoV-2, Influenza A und Influenza B ähnlich und für Influenza B sogar besser als für einen parallel untersuchten Kombi-Antigentest ausfiel (Batty et al.).
Kombi-Antigen-Schnelltests für SARS-CoV-2, Influenza A, Influenza B und RSV (respiratorisches Synzytial-Virus): Hierfür liegen m.W. bisher nur 2 (Validierungs-)Studien vor. In einer retrospektiven Laborstudie (mit zwischengelagerten Proben von Erwachsenen und Kindern) lag die Sensitivität des untersuchten Kombi-Schnelltests bei hohen Viruslasten (Ct<25) für SARS-CoV-2 bei 87,1%, für Influenza A bei 96,5%, für Influenza B bei 93,5% und für RSV bei 61,5%, während die Spezifität für SARS-CoV-2 und RSV jeweils 100% und für Influenza A und Influenza B jeweils ≥96% betrug (Bayart et al.). Dagegen lag die Spezifität eines in Deutschland vielfach (z.B. in einem bekannten Drogeriemarkt) angebotenen Kombi-Selbsttests in einer prospektiven klinischen (Real Life-)Studie (mit frischen Proben von Kindern) für SARS-CoV-2, Influenza und RSV jeweils bei 100%, während die Sensitivität bei hohen Viruslsaten (Ct<32) für SARS-CoV-2 bei 100%, Influenza bei 92,3% und RSV bei 87,2% lag (Ferrani et al.). Auffällig ist, dass in beiden Studien sowohl die Gesamt-Sensitivität als auch die Sensitivität bei hohen Viruslasten für RSV am geringsten ausfiel.
Fazit: Die in den zitierten Studien untersuchten Kombi-Antigen-Schnelltests/Selbsttests wiesen eine relativ hohe Sensitivität bei hohen Viruslasten (niedrigen Ct-Werten) und eine sehr hohe (Gesamt-)Spezifität (v.a. wenn frische Proben verwandt wurden) auf, wobei die Sensitivität für RSV am geringsten ausfiel. Jedoch liegt m.W. aktuell nur für einen der in Deutschland erhältlichen Kombi-Selbsttests (SARS-CoV-2, Influenza A/B & RSV) eine unabhängige Validierungsstudien vor, wobei bei Selbsttests vor der CE-Zertifizierung eine Prüfung der grundlegenden Sicherheits- und Leistungsanforderungen (bis 25.05.2022 gemäß IVDD, seit 26.05.2022 gemäß IVDR) durch eine "Benannte Stelle" (also unabhängig vom Hersteller) erfolgen muss.
Autor: Christian Erdmann, FH Münster, keine Interessenkonflikte, u.a. Mitautor einschlägiger Meta-Analysen (z.B. Brümmer et al., Katzenschlager et al.)
Hinweis: Es wurden auch einige Preprints (nicht begutachtete Vorab-Publikationen) zitiert/verlinkt (erkennbar an der URL medrxiv.org, papers.ssrn.com und researchsquare.com).
Artikelbild: Magnifying glass over test kits for viral disease COVID-19 by Marco Verch under Creative Commons 2.0