Letztes Update: 26.09.2023
ACHTUNG (18.12.2023): Hier findet man eine aktuellere FAQ.
In diesem Artikel wird folgenden Fragen (wissenschaftlich) nachgegangen:
- 1. Wie gut funktionieren Antigen-Schnelltests bei Omikron?
- 2. Ist Omikron im Rachen per Antigentest früher/besser nachweisbar?
- 3. Wann und warum kommt es zu falsch-negativen Antigentest-Ergebnissen?
- 4. Wie wahrscheinlich ist es, dass die Sensitivität von Antigentests bei den neuen Varianten BQ.1/BQ.1.1, BF.7, XBB.1/XBB.1.5/XBB.1.16, EG.5/EG.5.1 oder BA.2.86 beeinträchtigt ist?
1. Wie gut funktionieren Antigen-Schnelltests bei Omikron?
Letztes Update: 31.03.2023
Vorneweg: Die Untersuchungen des Paul-Ehrlich-Instituts (PEI) geben keinen Hinweis auf eine verringerte Sensitivität von Antigentests bei den Omikron-Subvarianten BA.1 und BA.2 (siehe weiter unten + Statement des PEI vom 10.6.22). Das PEI geht auch nicht von einer verringerten Sensitivität bei der Omikron-Subvariante BA.5 aus, weil diese [wie auch z.B. XBB.1.5/XBB.1.16; siehe unter Frage 4] im Vergleich zu BA.2 keine neue Mutation im N-Protein aufweist. Zudem liegen dem PEI mit Stand 6. Juli 2022 keine Hinweise auf eine verringerte Sensitivität bei der Omikron-Subvariante BA.4, die [wie auch BQ.1/BQ.1.1; siehe unter Frage 4] eine neue Mutation im N-Protein aufweist, vor. Studien zur Sensitivität bei BA.4 und BA.5 waren dem PEI zu dem Zeitpunkt aber jeweils (noch) nicht bekannt (Quelle: E-Mail-Verkehr vom 6. Juli 2022 mit Herrn Dr. Scheiblauer vom PEI; siehe auch hier). Für falsch-negative Ergebnisse gibt es oftmals plausible Gründe (siehe dazu ausführlicher unter Frage 3).
In knapp 40 Laborstudien (mit in Zellkultur angezüchteten Viren, rekombinantem Protein oder Verdünnungsreihen aus Archivproben) wurde für grob geschätzt ca. 50 Antigentests bei Omikron (v.a. BA.1, BA.1.1, BA.2, aber vereinzelt auch BA.4 und BA.5) eine ähnliche (in einzelnen Fällen sogar eine leicht höhere) analytische Sensitivität (Nachweisgrenze) im Vergleich zu Delta und/oder zur "Wildtyp"-Variante festgestellt (Deerain et al., Drain et al. (a), Faffe et al., FIND (a), FIND (b), FIND (c), FIND (d), FIND (e), FIND (f), FIND (g), FIND (h), FIND (i), FIND (j), FIND (k), FIND (l), FIND (m), FIND (n), FIND (o), Frank et al., Goderski et al., Hagag et al., Hardick et al., Hill et al., Jungnick et al., Liu et al., Mak et al., Meiners et al., Molenkamp & Igloi, Morinaga et al., Obata et al., Osterman et al. (a), PEI, Pillet et al., Regan et al., Raïch-Regué et al., Salcedo et al., Stanley et al., SSI DK (a), SSI DK (b), Thompson et al., UKHSA, Weishampel et al.). In 3 anderen Laborstudien wurde für 10 Antigentests bei Omikron (BA.1) ein Trend zu einer geringeren analytischen Sensitivität im Vergleich zu früheren Varianten beobachtet (Beklitz et al., Rao et al., Szekely et al.), wobei die meisten dieser 10 Tests in den vorgenannten Studien (teils mehrfach) keine geringere analytische Sensitivität bei Omikron zeigten. Die Unterschiede in den Studienergebnissen für die teils selben Tests könnten mit unterschiedlichen Methodiken zu erklären sein.
Die Laborstudien sprechen m.E. insgesamt eindeutig dafür, dass die analytische Sensitivität (Nachweisgrenze) der allermeisten Antigentests, die auf das N-Protein testen (das sind nahezu alle), bei Omikron (BA.1, BA.1.1, BA.2, BA.4, BA.5) ähnlich wie zuvor ist. Das heißt: Die Antigen-Konzentration, die in der Probe mindestens vorliegen muss, damit der Antigentest zuverlässig (zu 95-100%) anschlägt, wird bei den allermeisten Antigentests wahrscheinlich unverändert bzw. ähnlich wie zuvor sein. Das verwundert nicht, da es bei Omikron nur einzelne bzw. bei einigen Subvarianten keine neuen (bisher unbekannten) Mutationen im N-Protein gab.
Bestätigt wird dies durch die Untersuchungen des Paul-Ehrlich-Instituts (PEI) (siehe entsprechend auch Frank et al.). Denn die Antikörper der 20 untersuchten Antigentests, für die das PEI im Labor (mit gelagerten klinischen Proben und in Zellkultur) bei Omikron (BA.1) keine veränderte (analytische) Sensitivität im Vergleich zu Delta bzw. dem "Wildtyp" feststellen konnte, binden (in 18 Fällen, in 2 Fällen lag keine Information über die Bindungsstelle vor) in nicht mutierten Regionen des N-Proteins von Omikron (BA.1 und BA.2; gilt daher auch für BA.5). Dem PEI lagen mit Stand 23.3.2022 für 406 Antigentests genauere Informationen zur Bindungsstelle (Epitop) vor. In 385 Fällen lagen diese in nicht mutierten Regionen des N-Proteins von Omikron. In 21 Fällen nutzten die Antigentests Antikörper, die möglicherweise an einer mutierten Region binden (und für 22 andere Antigentests lag nur die ungenaue Information vor, dass die Antikörper am N-Protein binden). Die Hersteller*innen, für deren Tests noch keine (genaueren) Informationen zur Bindungsstelle vorlagen oder deren Tests möglicherweise von einer Mutation betroffen sind oder auf das S-Protein testen, mussten dem PEI die Informationen nachreichen bzw. ihre Tests selbst für Omikron validieren, um auf der BfArM-Liste (für erstattungsfähige Antigentests) zu bleiben. (Hinweis: Diese Liste gibt es nicht mehr. Es gilt nur noch die gemeinsame EU-Liste.)
Ist neben der analytischen Sensitivität (Nachweisgrenze) auch die klinische Sensitivität (Wahrscheinlichkeit, dass ein Antigentest eine infizierte Person erkennt, i.d.R. im Vergleich zum PCR-Test bestimmt) der allermeisten Antigentests bei Omikron unverändert bzw. ähnlich wie zuvor? Kurze Antwort: Meines Erachtens wahrscheinlich ja (und trotzdem ist die klinische Sensitivität im Vergleich zum PCR-Test nun um den Symptombeginn herum offensichtlich bedingt durch einen früheren Symptombeginn bei Vorimmunisierten wahrscheinlich im Schnitt verringert; siehe dazu ausführlicher unter Frage 3).
Lange Antwort: In über 30 prospektiven Real-Life-Studien (mit frischen Proben von A- und Symptomatischen, meist Geimpften, meist Erwachsenen, aber teils auch Kindern) lag die Sensitivität der ca. 20 in den Studien genutzten Antigentests bei hohen RNA-Viruslasten (≥10^6 RNA-Kopien/ml, wobei oft nur Ct-Werte angegeben sind) bei Omikron (v.a. BA.1 und BA.1.1, aber vereinzelt auch BA.2, BA.2.12, BA.4 und BA.5) weiterhin im Bereich von ca. 85%-95% im Vergleich zur PCR, sofern für den PCR-Test und den Antigentest dieselbe(n) Abstrichart(en) genutzt wurde(n) (Adamson et al., Bezerra et al., Cohen et al., de Michelena et al., Drain et al. (a), Drain et al. (b), Eyre et al., FIND (f), FIND (g), FIND (i), FIND (l), FIND (n), FIND (p), FIND (q), Galliez et al., Garcia-Cardenas et al., Goodall et al., Kam et al., Kyritisi et al., Landaverde et al., Li et al., Lin et al., Liu et al., Meiners et al., Murakami et al., Obata et al., Piek et al., Prazuck et al., Samsunder et al., Schrom et al. (a), Schrom et al. (b), Schuit et al. (a), Soni et al., Suzuki et al., Tsao et al., Wang et al., Wettengel et al., Winnet et al. (a); Anm.: in FIND (r) betrug die Sensitivität bei Ct≤25 nur ⌀68.5%, wobei unklar ist, welchen RNA-Viruslasten dies entspricht, da Ct-Werte nicht standardisiert sind, wobei die ebenfalls ermittelte Nachweisgrenze dafür spricht, dass es sich im Schnitt eher um mittelhohe als um hohe RNA-Viruslasten handelt). By the way: Die Sensitivität lässt sich etwas erhöhen, wenn man den (vorderen) Nasenabstrich mit einem Rachenabstrich kombiniert (siehe dazu ausführlicher unter Frage 2).
2 andere Real-Life-Studien (Wagenhäuser et al., Venekamp et al.) scheinen dem auf den ersten Blick zu widersprechen, so dass ich in der Folge darauf näher eingehen will:
In Wagenhäuser et al. nahm die (durchschnittliche) Sensitivität (für 3 Antigentests) bei hohen RNA-Viruslasten von der "Wildtyp"-Variante über Alpha und Delta bis hin zu Omikron (wahrscheinlich BA.1) kontinuierlich ab. Hierbei handelt es sich jedoch m.E. wahrscheinlich eher um eine Abnahme der Sensitivität in Folge der zunehmenden Grundimmunisierung (v.a. durch Impfung) (vgl. Meiners et al.; siehe dazu ausführlicher unter Frage 3; Update: In der peer-reviewten Version der Studie wird dieser Punkt nun auch im Diskussionsteil angesprochen). Dafür spricht auch, dass die analytische Sensitivität für 2 der 3 Antigentests laut mehreren Studien (Deerain et al., FIND (j), Jungnick et al., Meiners et al., Molenkamp & Igloi, Raïch-Regué et al., SSI DK) bei Omikron (BA.1 und BA.2) unverändert war (für den anderen der 3 Antigentests liegt keine analytische Studie vor) und dass laut PEI die Antikörper der 3 Antigentests in nicht mutierten Regionen des N-Proteins von Omikron (BA.1 und BA.2) binden. Es wäre auch nicht sinnig, zu argumentieren (das machen die Autor*innen allerdings auch nicht!), dass die Sensitivität durch immer weitere Mutationen stetig abgenommen hat, weil z.B. Omikron gar kein Derivat (Abkömmling) von Delta darstellt. By the way: Die in der Studie (und auch in der neuen Studie der Autor*innengruppe: Krone et al.) generell relativ* geringe Sensitivität bei hohen RNA-Viruslasten (*im Vergleich zu früheren Real-Life-Studien für die 3 Antigentests sowie im Vergleich zu aktuellen Real-Life-Studien für einen der 3 Antigentests) könnte möglicherweise damit zu erklären sein, dass viele der in der Studie ins Krankenhaus aufgenommenen Patient*innen trotz hoher RNA-Viruslast nicht mehr ansteckend waren, weil sie sich (und das ist bei aufgenommenen COVID-19-Patient*innen, aber auch bei asymptomatischen Patient*innen bzw. Zufallsbefunden wahrscheinlicher) in einem späten Stadium der (akuten) Infektion befunden haben, wo neutralisierende Antikörper (nicht nur durch ggf. vorherige Infektion und/oder Impfung, sondern auch durch die aktuelle Infektion induziert) die Infektiosität reduzieren (z.B. van Kampen et al. i.V.m. Ke et al., Luna-Muschi et al.).
In Venekamp et al. haben asymptomatische, überwiegend geimpfte Personen, während Omikron dominant war, einen Selbsttest mit Nasenabstrich durchgeführt, wobei die Sensitivität der 3 in der Studie genutzten Antigentests bei mittelhohen und hohen RNA-Viruslusten (≥5,2 RNA-Kopien/ml) im Schnitt zwischen 40-50% lag. Jedoch wurden Asymptomatische, die kurz vorher einen positiven Selbsttest hatten, ausgeschlossen. Das führt zu einem Bias (Verzerrung) in Richtung erhöhter falsch-negativer Ergebnisse - v.a. weil wahrscheinlich einige der Infizierten, die vorher keinen positiven Selbsttests hatten, innerhalb der letzten 7 Tagen ebenfalls einen Selbsttest durchgeführt hatten (siehe Tabelle 1 in der Studie). By the way: In der entsprechenden Studie der Autor*innengruppe mit Symptomatischen (Schuit et al. (a)) wurden Personen mit vorherigem positiven Selbsttest nicht ausgeschlossen. Schließt man die asymptomatischen Personen mit vorherigem positiven Selbsttest ein, erhöht sich die Sensitivität bei (mittel)hohen Viruslasten auf im Schnitt 60-70% (siehe Supplementary Material, Tabelle S2). Dass die Sensitivität bei (mittel)hohen Viruslasten im Vergleich zu Symptomatischen (Schuit et al. (a)) geringer ist, könnte folgende 2 Gründe haben: Erstens ist die Wahrscheinlichkeit, dass Asymptomatische sich in einem späten Stadium der (akuten) Infektion, wo man trotz hoher RNA-Viruslasten häufig(er) nicht mehr ansteckend ist (siehe oben bzw. ausführlicher unter Frage 3), testen generell höher als bei Symptomatischen - auch weil Asymptomatische wahrscheinlich im Schnitt etwas kürzer ansteckend sind (Hay et al.). Zweitens ist es (und das ist kein Gegensatz) nicht unwahrscheinlich, dass sich (zudem) mehr Asymptomatische (oft wahrscheinlich Präsymptomatische) in der sehr frühen Infektionsphase, in der die Antigen-Konzentration trotz hoher (möglicherweise bereits ansteckender) RNA-Viruslast oft noch nicht ausreichend ist (siehe dazu ausführlicher unter Frage 3), getestet haben, da viele Infizierte wahrscheinlich Kontaktpersonen waren (siehe Tabelle 1). Eine generelle Limitation der Studie, die zu einer wahrscheinlich unterschätzten Sensitivität der Antigentests führt, ist, dass für den PCR-Test in der Studie ein Rachenabstrich mit einem Nasen- oder einem Nasen-Rachen-Abstrich kombiniert, beim Selbsttest aber nur ein Nasenabstrich durchgeführt wurde. Hätte man beim Selbsttest auch 2 Abstriche kombiniert, wäre die durchschnittliche Sensitivität wahrscheinlich etwas höher gewesen (siehe dazu ausführlicher unter Frage 2).
An der Stelle noch ein Kommentar zu der anderen Studie der Autor*innengruppe mit (zu ca. 80% geimpften) Symptomatischen (Schuit et al. (a)): Hier wurde die Sensitivität derselben 3 Antigen-Selbsttests mit Nasenabstrich (wie in Venekamp et al.) in Kalenderwoche (KW) 51 des Jahres 2021 (29% Omikron-Anteil) mit der in KW 3 (>90% Omikron-Anteil; gilt für 2 der 3 Tests) bzw. mit der in KW 5 (99% Omikron- bzw. >95% BA.1-Anteil; gilt für einen der 3 Tests) des Jahres 2022 verglichen. Dabei nahm die Sensitivität bei mittelhoher und hoher RNA-Viruslast (≥10^5,2 RNA-Kopien/ml) jeweils ab (jedoch nur für einen der drei Tests statistisch signifikant; mutmaßlich wäre die statistische Signifikanz verlorengegangen, wenn dieser Test auch noch bis KW5 mit Nasenabstrich untersucht worden wäre; vgl. Studiengrafik 7). Was dagegen spricht, dass die Sensitivitätsabnahme Omikron-bedingt ist, ist, dass die Sensitivität nach KW51 2021 erst jeweils abnahm und dann (mit weiter zunehmenden Omikron-Anteil) bis KW 3 bzw. 5 2022 jeweils wieder zunahm (siehe Studiengrafik 7). Da die Nachweisgrenze (analytische Sensitivität) der meisten Antigentests bei ca. 10^6 RNA-Kopien/ml liegt, kann es sein, dass es mal mehr, mal weniger Infizierte mit RNA-Viruslasten um die Nachweisgrenze herum gab (v.a. zwischen 10^5,2 und 10^6 RNA-Kopien/ml), wo der Antigentest oft (noch oder wieder) negativ ausfällt (die Information kann man der Studie leider nicht entnehmen, da nicht weiter nach RNA-Viruslast differenziert wurde). Dies könnte aus mit der Zeit unterschiedlichen Testverhalten, auch infolge zeitweiser begrenzter/ausgelasteter Testkapazitäten, resultieren (siehe auch Diskussionsteil in der Studie): Tritt eine neue Variante auf, lässt man sich wahrscheinlich tendenziell früher testen, also v.a. bei Geimpften wahrscheinlich oft vor dem Viruslast-Gipfel (siehe dazu ausführlicher unter Frage 3) (→ Sensitivität nimmt im Schnitt ab), bei ausgelasteten Testkapazitäten findet der Test im Schnitt später statt, also v.a. bei Geimpften wahrscheinlich öfters bei dann höherer Viruslast (→ Sensitivität nimmt im Schnitt wieder zu). Zudem wurden auch hier in den Wochen KW 51 2021 bis KW 3 bzw. 5 für den PCR-Test ein Rachenabstrich mit einem Nasen- oder einem Nasen-Rachen-Abstrich kombiniert, während der Selbsttest nur mit Nasenabstrich erfolgte. In den KW 4-6 2022 (die nicht in den obigen Vergleich über die Zeit eingingen) hat man dann testweise bei 2 Selbsttests ebenfalls den Rachen- und Nasenabstrich kombiniert, wodurch sich die Sensitivität bei (mittel)hohen RNA-Viruslasten im Schnitt um ca. 5-10%-Punkte erhöhte. Sollte Omikron etwas früher im Rachen nachweisbar sein als Delta (siehe dazu ausführlicher unter Frage 2), könnte das auch (teils) eine Erklärung für die mit der Zeit (kurzzeitig) abnehmende Sensitivität der Selbsttests mit Nasenabstrich (im Vergleich zum PCR-Test inkl. Rachenabstrich) sein, weil man sich - wie oben dargestellt - bei Auftreten einer neuen Variante wahrscheinlich tendenziell früher testet.
Einer der verlässlichsten Hinweise auf eine potenzielle Infektiosität (Ansteckungsfähigkeit) ist eine positive Viruskultur (= erfolgreiche Virusanzucht). In 3 prospektiven klinischen Studien (mit frischen Proben) lag die Sensitivität der 3 Antigentests im Vergleich zur Viruskultur bei Durchbruchsinfektionen mit Omikron (BA.1, BA.1.1) bei jeweils 100% (Cosimi et al., Lohse et al., Luna-Muschi et al.), wobei die Stichprobe jeweils relativ klein war und die Antigentests jeweils erst ein paar Tage nach dem Symptombeginn und/oder nach einem positiven PCR-Test erfolgten. In (retrospektiven) Laborstudien (mit zwischengelagerten Proben) lag die durchschnittliche Sensitivität bei Omikron-Durchbruchsinfektionen (v.a. BA.1, BA.1.1) dagegen bei 70,5% (7 Antigentests: Range 50-94,6%; Beklitz et al.), 78% (1 Antigentest; Boucau et al.) und 92,9% (4 Antigentests; Hardick et al.) im Vergleich zur Viruskultur, wobei die Behandlung, der Transport und/oder die Lagerung der Proben in den Studien zu einer verminderten Sensitivität geführt haben könnten (siehe unten den Abschnitt nach dem Fazit).
FAZIT: Sowohl Laborstudien (analytische Studien) als auch Real-Life-Studien (prospektive klinische Studien) lassen m.E. insgesamt keine veränderte analytische und klinische Sensitivität bei Omikron (BA.1, BA.1.1, BA.2, BA.2.21, BA.4, BA.5) erkennen. Dennoch ist die klinische Sensitivität (im Vergleich zum PCR-Test) nun um den Symptombeginn herum offensichtlich bedingt durch einen früheren Symptombeginn bei Vorimmunisierten wahrscheinlich im Schnitt verringert (siehe dazu ausführlicher unter Frage 3), so dass (auch laut Christian Drosten) der Anschein entstehen könnte, dass die Sensitivität bei Omikron geringer sei.
Nur der Vollständigkeit halber möchte ich hier noch Laborstudien erwähnen, die die Sensitivität von Antigentests retrospektiv mit (zwischen)gelagerten Proben untersucht haben. Diese haben jedoch - wie unten dargestellt - methodisch bedingt einige Limitationen, was zu einer geringe(re)n Aussagekraft führt (im Vergleich zu prospektiven klinischen Studien mit frischen Proben).
In einigen retrospektiven Laborstudien zeigte sich für verschiedene Antigentests (bei hohen RNA-Viruslasten) eine ähnliche (in einzelnen Fällen sogar eine leicht höhere) Sensitivität bei Omikron (BA.1, BA.1.1, BA.2, vereinzelt auch BA.4 und BA.5) (fast immer) im Vergleich zu Delta (Bayart et al., Beklitz et al., Gourgeon et al., Hardick et al., Jungnick et al., Kanjilal et al. (a), Kanjilal et al. (b), Krutova et al., Medoro et al., Nasrallah et al., Osterman et al. (a), Osterman et al. (b), PEI, Sugiharto et al., Uster et al.; s.a. Cubas Atienzar et al., Barrera-Avalos et al.), während sich in einzelnen retrospektiven Laborstudien für einige Antigentests (teils für dieselben wie in den zuvorgenannten Studien) eine geringere Sensitivität ergab (Beklitz et al., Osterman et al. (a), Osterman et al. (b)).
Die retrospektive Laborstudie von Leuzinger et al., die (überraschenderweise) zumindest bei einem Antigentest eine statistisch signifikant reduzierte Sensitivität bei BA.2 im Vergleich zu BA.1 (und BA.5) bzw. bei BA.5 im Vergleich zu BA.1 zeigte, habe ich hier ausführlich besprochen. Eine weitere retrospektive Laborstudie (Osterman et al. (b)) zeigte für 5 Antigentests bei BA.1 und BA.2 ähnliche Sensitivitäten.
Obgleich nicht alle nachfolgenden Limitationen auf jede retrospektive Laborstudie zutreffen, sei allgemein dazu gesagt: Durch die Nutzung eines VTM (Virustransportmediums), UTM (Universaltranspotmediums) oder Ähnliches (z.B. NaCl, PBS) zwecks Transport/Lagerung der Probe kann es je nach Transportmedium und je nach Antigentest (die Tests nutzen unterschiedliche Antikörper) zu einem Abbau der (nachzuweisenden) viralen Antigene (bei unveränderter RNA-Viruslast!) (Oguri et al.) und/oder zur Inaktivierung der (nachweisenden) Test-eigenen Antikörper kommen (Zhou et al.). Darüber hinaus kann ein Transportmedium - je nach Menge des Aliquots (= Teilmenge einer Probe) - die Pufferlösung des Tests verdünnen und somit die Test-Sensitivität verringern (Kenyeres et al., Perchetti et al.). Ferner kann eine vorherige Virusinaktivierung durch Hitze die Sensitiviät negativ beeinträchtigen (Zhou et al.). Ein oder mehrere Frost-/Auftauzyklen können die Antigen-Konzentration ebenfalls reduzieren, eine kühle Lagerung für bis zu 1 Woche dagegen wahrscheinlich eher nicht (Scheiblauer et al.). Erst recht, wenn man nach der Aufnahme der Probe in ein Transportmedium und nach der Lagerung bzw. nach dem Auftauen nicht noch mal die RNA-Viruslast misst, kommt es wahrscheinlich zu einer Unterschätzung der Sensitivität der Antigentests, weil die RNA-Konzentration ebenfalls durch die Transport-/Lagerbedingungen abnehmen kann. Generell kann/sollte man aus retrospektiven Studien keine realen/klinischen Sensitivitäten von Antigentests ableiten, man kann mit solchen Studien maximal* die Sensitivität verschiedener Antigentests unter möglichst identischen Bedingungen miteinander vergleichen (Beklitz et al.) (*limitierend ist - wie gesagt - dass verschiedene Tests unterschiedlich mit einem Transportmedium interagieren könnten). Vergleicht man zudem die Sensitivität bei unterschiedlichen Varianten auf Basis von unterschiedlichen Proben, sollte man die Proben möglichst matchen (vergleichbar machen). Und zwar nicht nur in Bezug auf die RNA-Viruslast, sondern auch hinsichtlich des genutzten Transportmediums, der Lagerung (Temperatur und Zeit, wobei Letzteres praktisch oft schwierig ist), der Abstrichart, des Impf- und/oder Genesenenstatus (idealerweise inkl. der vergangenen Zeit seit der letzten Impfung/Infektion) sowie des Symptomstatus bzw. des Tages der Probenahme (nach Symptombeginn/Exposition), weil die vorgenannten Faktoren (auch) die Antigen-Konzentration bzw. das Verhältnis von Antigen- zu RNA-Konzentration beeinflussen können (siehe oben und unter Frage 3). Idealerweise versucht man, aus den (gematchten) Proben im Labor (in Zellkultur) "lebendes" (potenziell ansteckungsfähiges) Virus anzuzüchten, und ermittelt dann pro Variante den Anteil der vom Antigentest erkannten potenziell infektiösen Proben. Alternativ könnte man auch die Antigen-Konzentrationen der (gematchten) Proben vorab mit einem quantitativem Antigentest bestimmen, um das Verhältnis von Antigen- zu RNA-Konzentration bei den verglichenen Proben (mit unterschiedlichen Varianten) zu bestimmen (was aber nur Sinn macht, wenn bekannt ist, dass die Sensitivität des quantitativen Antigentests bei den untersuchten Varianten ähnlich ist). Sollte sich das Verhältnis von Antigen- zu RNA-Konzentration in den verglichenen (gematchten) Proben (mit unterschiedlichen Varianten) unterscheiden, ist es zu erwarten, dass sich die Sensitivität (zumindest im Vergleich zum PCR-Test*) ebenfalls unterscheidet (*die analytische Sensitivität [definiert als kleinste Antigen-Konzentration, die vom Antigentest noch zuverlässig erkannt werden kann] und die Sensitivität im Vergleich zur Viruskultur kann davon unberührt sein!). In dem Fall ist es zu klären, ob das unterschiedliche Verhältnis von Antigen- zu RNA-Konzentration der verglichenen Proben an einem unzureichenden Matching der Proben oder den unterschiedlichen Varianten per se liegt.
2. Ist Omikron im Rachen per Antigentest früher/besser nachweisbar?
Letztes Update: 16.07.2022
Vorab: Dies stellt keine Empfehlung dar, Schnell-/Selbsttests abweichend von der Gebrauchsanweisung zu verwenden (v.a. weil das Stäbchen einiger nicht für den Rachenabstrich vorgesehener Tests mitunter zu kurz und/oder zu unflexibel ist, um ordentlich in/an den Rachen zu kommen).
Kurze Antwort: Ein kombinierter Rachen- und Nasen(selbst)abstrich erhöht (auch bei Omikron) die Sensitivität von Antigentests im Schnitt um ca. 5-20%-Punkte.
Lange Antwort: Zunächst gab es anekdotische Hinweise darauf, dass Antigentests mit einem (zusätzlichen) Rachenabstrich früher anschlagen als (nur) mit einem Nasenabstrich. Die gab es jedoch bei den letzten Varianten jeweils auch. Hier besteht immer die Gefahr eines "reporting bias" (also einer Verzerrung dadurch, dass hauptsächlich nur dann berichtet wird, wenn es Auffälligkeiten gibt).
In der Studie von Schrom et al. (a) wurde bei 115 Personen (Symptom- und Impfstatus unklar) ein Nasen- und ein separater Rachenabstrich, jeweils für einen Antigen- und einen PCR-Test, abgenommen. Der Antigentest mit alleinigem Nasenabstrich hat 85,7% und der Antigentest mit alleinigem Rachenabstrich hat nur 46,9% der Omikron-Infizierten (BA.1, BA.1.1) mit hohen RNA-Viruslasten (Ct-Wert <30) in der Nase und/oder dem Rachen erkannt (siehe Bild unten). Kombiniert man die Ergebnisse beider Abstriche, wurden 89,8% der Personen mit hoher RNA-Viruslast erkannt (also nur <5% mehr im Vergleich zum alleinigen Antigentest mit Nasenabstrich).
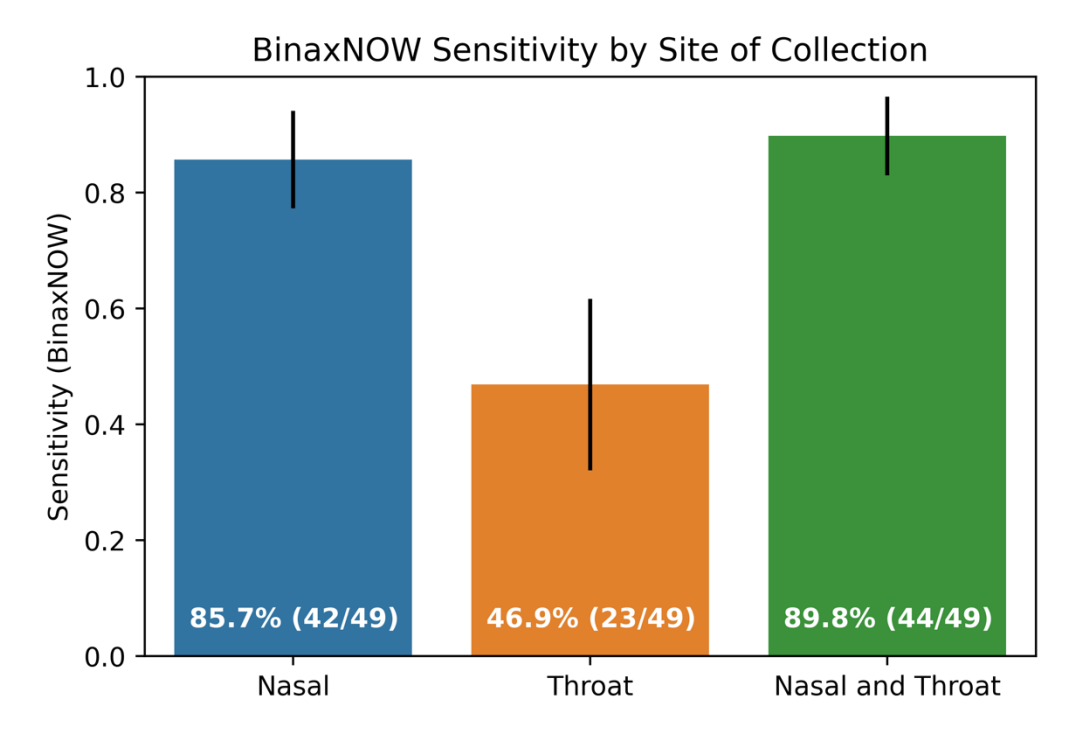
Es handelte sich jedoch um keine Verlaufsstudie. Sprich: Von jeder Person wurden nur einmalig, also zu einem einzigen Zeitpunkt, Abstriche abgenommen (und nicht über mehrere Tage). Deshalb kann man aus der Studie nicht herauslesen, ob der Rachen- oder der Nasenabstrich am Anfang der Infektion bzw. Infektiosität möglicherweise (im Schnitt) früher anschlägt. Da aber der alleinige Rachenabstrich bei hohen RNA-Viruslasten (in Rachen und/oder Nase) deutlich seltener anschlug als der alleinige Nasenabstrich, sollte m.E. beim Schnelltesten via Antigentest kein alleiniger Rachenabstrich erfolgen. Auffällig ist auch, dass beim PCR-Test mit Rachenabstrich nur 58 und mit Nasenabstrich 92 Infizierte erkannt wurden (siehe Tabelle 4 in der Studie). Das spricht für eine unterschiedliche Viruskinetik (zeitlicher Verlauf der Viruslast) in Rachen und Nase. Unabhängig davon, ob die RNA-Viruslast im Rachen eventuell früher höher ist als in der Nase, sprechen die obigen Daten dafür, dass die Viruslast im Rachen im Schnitt (merklich) früher wieder abfällt als in der Nase (vgl. auch Cornette et al., Lin et al., Winnett et al. (a), Winnett et al. (b)).
In der Studie von Goodall et al. lag dagegen die Sensitivität der kombinierten Ergebnisse beider Abstriche (Nasen- und separater Rachen-Selbstabstrich) bei asymptomatischen Omikron-Infizierten (wahrscheinlich BA.1; Impfstatus unklar) eindeutig höher (88,7% bzw. 95,1% → das Ganze wurde für 2 Antigentests unterschiedlicher Marken durchgeführt) als die Sensitivität des alleinigen Nasen- (64,5% bzw. 78,1%) oder Rachen-Selbstabstrichs (64,5% bzw. 63,4%) (siehe Tabelle unten). Zusätzlich bzw. entsprechend zeigte sich, dass der kombinierte Rachen- und Nasen-Selbstabstrich (also beide Abstriche hintereinander für denselben Antigentest) ebenfalls eindeutig sensitiver war (81,6%) als der alleinige Nasen-Selbstabstrich (68,4%).
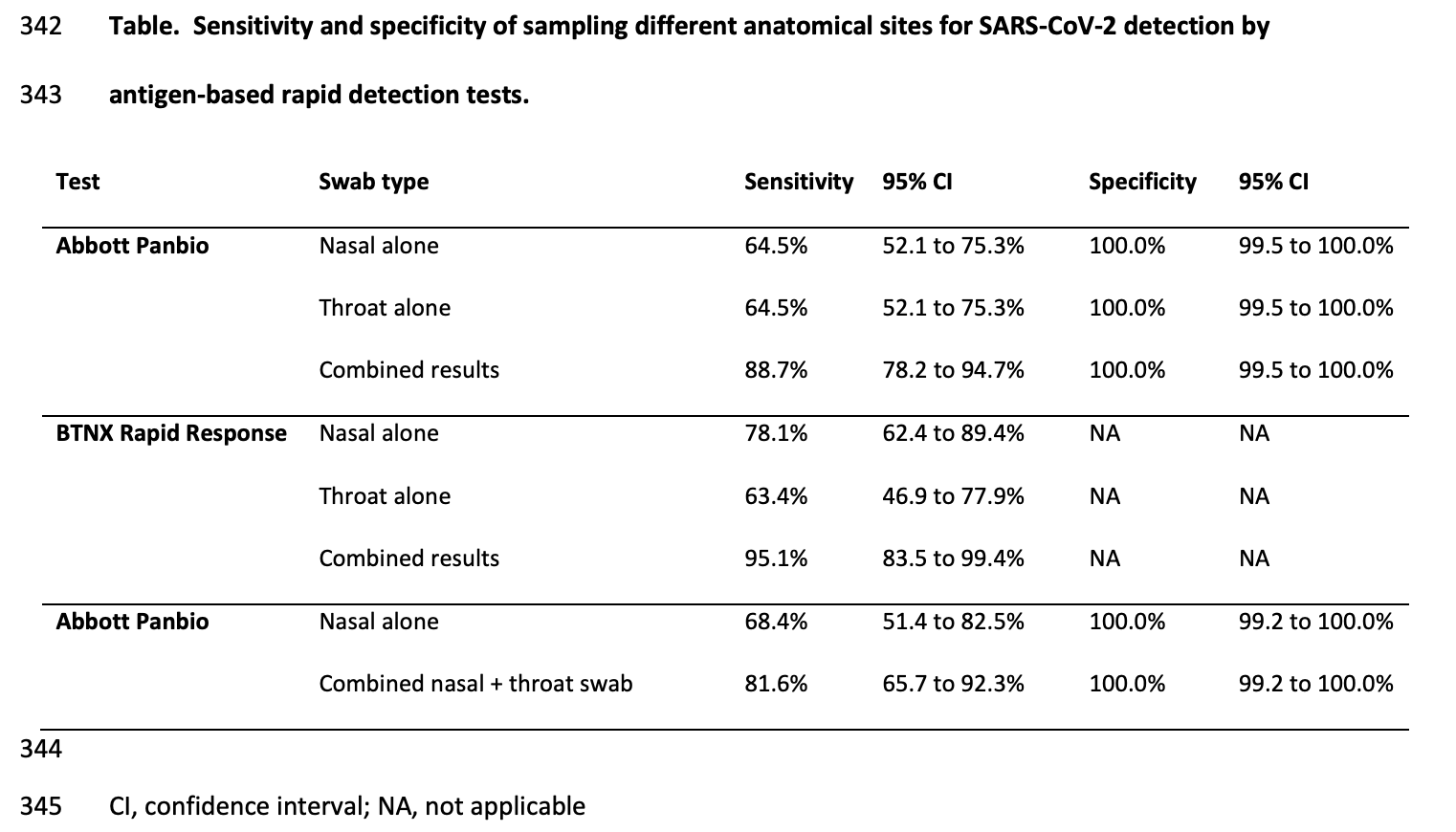
Da es sich wieder um keine Verlaufsstudie handelt, kann man aus der Studie wieder nicht herauslesen, ob der Rachen- oder der Nasenabstrich am Anfang der Infektion bzw. Infektiosität möglicherweise (im Schnitt) früher anschlägt. Da der (alleinige) Nasenabstrich aber hier (zumindest bei einem der beiden untersuchten Antigentests) erneut im Schnitt besser abschnitt als der (alleinige) Rachenabstrich und sich mutmaßlich einige der Infizierten (die allesamt keine Symptome berichteten) in der präsymptomatischen Phase (= frühe Infektionsphase vor Symptombeginn) befanden, könnte das ein Hinweis darauf sein, dass der Rachenabstrich, wenn, dann im Schnitt nicht viel früher (eher Stunden als Tage) beim Antigentest positiv wird als der Nasenabstrich. By the way: In der Studie wurden angeleitete und überwachte Selbstabstriche durchgeführt: Nur 6% lehnten Selbstabstriche von vorherein ab. Der Rachen-Selbstabstrich wurde meist korrekt durchgeführt (nur selten musste von außen verbal korrigiert werden). Zwar gab es oft einen Würgereiz (was normal ist), aber nur eine Person (von 1345) erbrach.
In der Human-Challenge-Studie von Killingley et al. haben sich 18 ungeimpfte Personen mit der "Wildtyp"-Variante infiziert. Von diesen wurde über den gesamten Infektionsverlauf täglich (mindestens) ein Nasen- und ein separater Rachenabstrich abgenommen. Diese wurden jeweils mit einem PCR-Test, einem Antigentest und in Zellkultur (auf "lebendes" Virus) getestet. Obwohl die virale RNA (per PCR-Test) und das Virus (in der Zellkultur) im Rachen jeweils im Schnitt etwas früher (im Median ca. 18 Stunden) nachweisbar war als in der Nase, schlug der Antigentest mit Abstrich aus der Nasenmuschel im Median genauso früh an wie der Antigentest mit Rachenabstrich (an Tag 4 nach Infektion; siehe unten im Bild den Graphen a). Das liegt vermutlich daran, dass im Rachen eine hohe, vom Antigentest zuverlässig nachweisbare Viruslast (10^6 RNA-Kopien/ml) im Schnitt nur weniger als 12 Stunden früher vorlag als in der Nase (siehe Studiengrafik 2, die hier nicht abgebildet ist). By the way: Die Antigentests schlugen im Median ca. 24-48 Stunden nach dem ersten positiven PCR-Test (Graph b) bzw. im Median innerhalb der 24 Stunden nach der ersten positiven Zellkultur (Virusanzucht) an (Graph c).
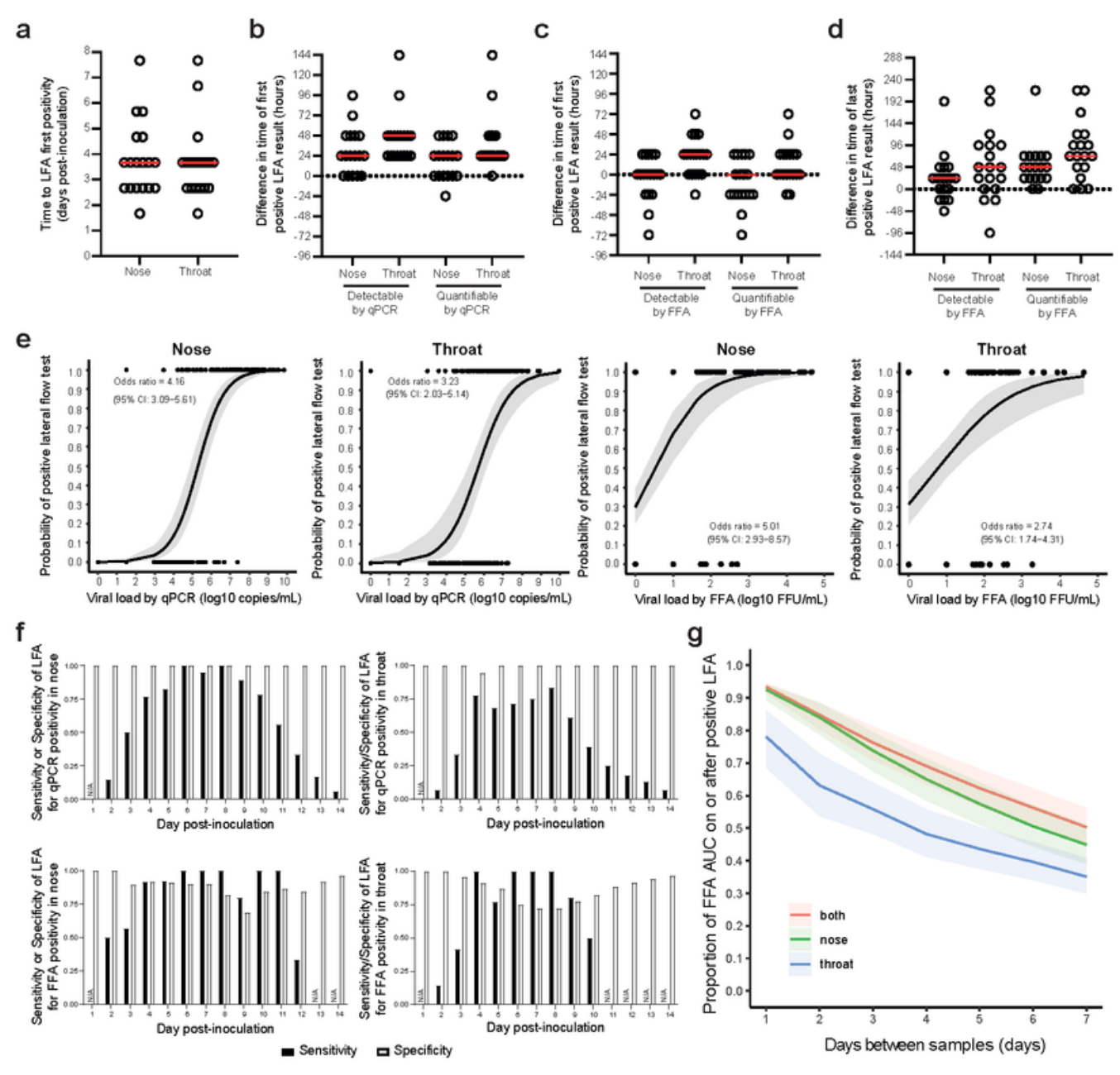
Über den gesamten Infektionsverlauf gesehen war die Sensitivität des Antigentests mit Nasenabstrich (im Vergleich zum PCR-Test/zur positiven Viruskultur) höher als die des Antigentests mit Rachenabstrich, wobei die Sensitivität bei Kombination der Ergebnisse beider Abstriche minimal höher war als beim alleinigen Nasenabstrich (siehe im Bild oben die Graphen f und g).
Da die virale RNA (bei Ungeimpften) zumindest auch beim "Wildtyp" (aus dem sich Omikron wahrscheinlich entwickelt hat) im Schnitt etwas früher im Rachen als in der Nase, dafür aber im Schnitt etwas höher und länger in der Nase als im Rachen nachweisbar war, könnte es sich eventuell eher um ein SARS-CoV-2-spezifisches als um ein Omikron-spezifisches Phänomen handeln.
So wurde auch im Preprint von Zwart et al. festgestellt, dass der kombinierte Rachen- und Nasenabstrich bei im Gesundheitsbereich durchgeführten Antigen-Selbsttests schon in der Zeit vor der Alpha-Variante etwas sensitiver war als der alleinige Abstrich aus der Nasenmuschel (insgesamt im Schnitt ca. 10% bzw. bei hohen RNA-Viruslasten im Schnitt ca. 20%).
Zudem gab es - wie eingangs erwähnt - bei jeder neuen Variante anekdotische Hinweise darauf, dass der (zusätzliche) Rachenabstrich die Sensitivität im Schnitt etwas erhöhen könnte.
Im Preprint von Lin et al. haben 3 mit Omikron-Infizierte (wahrscheinlich BA.1; Impfstatus unklar) täglich über 8-11 Tage ab Tag 1 nach Symptombeginn eine selbst abgenommene Probe aus der vorderen Nase, aus dem Rachen und aus dem Mund (Speichel bzw. Spucke) abgegeben. Diese wurden jeweils mit einem quantitativen Antigen- und einem PCR-Test getestet. Es zeigte sich, dass sowohl die Antigen-Konzentration als auch die RNA-Viruslast (hier als Ct-Wert angegeben, der antiproportional zur Viruslast verläuft) durchschnittlich bzw. zu fast allen Zeitpunkten in der Nase höher war als im Rachen oder Speichel:
Eine Limitationen könnte sein, dass es sich um selbst abgenommene Proben handelte (und daher v.a. die Antigen- und RNA-Konzentration im Rachen eventuell unterschätzt ist). Zusätzlich wurden auch Antigen-Selbsttests zu Hause (Probenart unklar) durchgeführt. Der Selbsttest war bei einer Person bereits vor Symptombeginn (siehe oben Diagramm B), bei einer Person am Tag des Symptombeginns (siehe Diagramm A) und bei einer Person einen Tag nach Symptombeginn (siehe Diagramm C; der PCR-Test war am Tag des Symptombeginns auch noch negativ!) erstmals positiv (siehe das "+" und "-" auf der X-Achse in den Diagrammen oben). Zwei der drei Personen haben danach täglich weiter (selbst)getestet. Die Selbsttests waren in der Folge bei hohen RNA-Viruslasten konstant positiv. Insgesamt kann man aus dieser Studie wieder (nur) ableiten, dass der Nasen(selbst)abstrich beim Schnelltesten via Antigentest über den gesamten Infektionsverlauf gesehen wahrscheinlich im Schnitt am sensitivsten ist.
In der Studie von Schuit et al. (a) zeigte der kombinierte Rachen- und Nasen-Selbstabstrich bei 2 Antigen-Selbsttests eine im Schnitt um ca. 5-10%-Punkte erhöhte Sensitivität bei (mittel)hohen Omikron(BA.1)-Viruslasten (im Rachen und im Nasen-Rachen-Raum bzw. in der Nase) im Vergleich zum alleinigen Nasenabstrich (gut 80% waren vollständig geimpft).
Im Preprint von Winnet et al. (a) haben Kontaktpersonen täglich u.a. eine selbst abgenommene Probe aus der vorderen Nase und dem Rachen für den PCR-Test abgegeben und zusätzlich einen Antigen-Selbsttest mit vorderem Nasenabstrich durchgeführt (es handelt sich also um eine Verlaufsstudie). In die Auswertung wurden 17 mit Omikron (BA.1, BA.1.1) infizierte (geimpfte) Personen eingeschlossen, die bei mindestens einem der ersten Tests noch negativ waren und sich somit wahrscheinlich am Anfang der Infektion befunden haben (bei 8 Personen waren alle ersten Tests negativ). Das Virus war in 6 Fällen früher im Rachen und in 2 Fällen früher in der Nase per PCR-Test nachweisbar (in 9 Fällen am selben Tag; siehe Studiengrafik 3). Eine hohe RNA-Viruslast (≥10^6 RNA-Kopien/ml) wurde in 8 Fällen zuerst im Rachen und in ebenfalls 8 Fällen zuerst in der Nase gemessen (in einem Fall am selben Tag; siehe Studiengrafik 4C). In den 8 Fällen, wo eine hohe RNA-Viruslast zuerst im Rachen erreicht war, schlug der Antigen-Selbsttest mit Nasenabstrich im Schnitt ca. 1-2 Tage später an. Basierend auf den Verlaufssdaten aus der Studie müsste ein Antigen(selbst)test mit Nasenabstrich bei einer (gewöhnlichen) Nachweisgrenze von 10^6 RNA-Kopien/ml theoretisch im Schnitt zu 73% anschlagen (in der Studie waren es ca. 70%), wenn bei Omikron (BA.1, BA.1.1) die RNA-Viruslasten in der Nase, im Rachen und/oder im Speichel hoch sind. Bei einem kombinierten Rachen- und Nasen-(Selbst)Abstrich dagegen wären es theoretisch im Schnitt 95%.
FAZIT: Ein kombinierter Rachen- und Nasen(selbst)abstrich zeigte in einzelnen prospektiven klinischen Studien (Real-Life-Studien) bei Omikron (BA.1, BA.1.1), aber auch bereits beim "Wildtyp", eine im Schnitt um ca. 5-20%-Punkte erhöhte Sensitivität im Vergleich zum alleinigen Nasen(selbst)abstrich. Mangels Verlaufsstudien (Längsschnittstudien) für Omikron, in denen ein Antigentest mit Nasen- und parallel zusätzlich ein Antigentest mit Rachenabstrich durchgeführt wurde, ist unklar, ob Omikron im Rachen per Antigentest im Schnitt früher nachweisbar ist. Die Längsschnittstudien von Lin et al. und Winnet et al. (a) und die vorhandenen Querschnittsstudien für Omikron (BA.1, BA.1.1) sowie die Human-Challenge-(Verlaufs-)Studie mit dem "Wildtyp" lassen vermuten, dass das Virus zwar im Schnitt etwas früher im Rachen per PCR-Test, aber im Schnitt nicht merklich früher per Antigentest nachweisbar ist (so kann es sein, dass mal der Nasen- und mal der Rachenabstrich beim Antigentest früher anschlägt). Ferner sprechen die vorgenannten Studien dafür, dass der alleinige Nasen(selbst)abstrich über den gesamten Infektionsverlauf gesehen beim Schnelltesten via Antigentest im Schnitt sensitiver ist als der alleinige Rachen(selbst)abstrich.
3. Wann und warum kommt es zu falsch-negativen Antigentest-Ergebnissen?
Letztes Update: 11.10.2022
Grundsätzlich ist bekannt, dass die Nachweisgrenze (analytische Sensitivität) der meisten Antigentests im oder um den Bereich der (bisher bekannten) Infektiositätsschwelle (= RNA-Viruslast, ab der man i.d.R. in Zellkultur "lebendes" Virus anzüchten/nachweisen kann) herum liegt (z.B. Cubas Atienzar et al., Deerain et al., Kontogianni et al.). Das heißt einerseits, dass die meisten Antigentests gut (wenn auch nicht perfekt) bei hohen, potenziell ansteckungsfähigen RNA-Viruslasten anschlagen (z.B. Brümmer et al., eigener Review). Andererseits kommt es daher bei geringen bis mittleren, i.d.R. jedoch nicht ansteckungsfähigen RNA-Viruslasten meist zu falsch-negativen Ergebnissen (im Vergleich zum PCR-Test). Während Letzteres nach hinten raus (wenn man nicht mehr ansteckend ist) weitgehend irrelevant ist, kann ein falsch-negatives Ergebnis im Viruslast-Anstieg (wenn man noch nicht ansteckend ist) eine falsche Sicherheit bedeuten. Auch wenn Antigentests ein gutes Tool darstellen, um Positive bzw. potenziell Ansteckende zu entdecken, sollte daher bzw. generell bitte beachtet werden, dass ein negativer Antigentest nie eine Infektion ausschließen kann!
Was sind weitere Hintergründe für falsch-negative Ergebnisse bei Antigentests?
- Bei Vorimmunisierten (durch Impfung und/oder Infektion) beginnen die Symptome aufgrund der schnelleren Immunreaktion im Schnitt offensichtlich früher (vgl. Landon et al., Meiners et al.). Dafür spricht u.a. laut Christian Drosten auch, dass die Inkubationszeit (= Zeit von Ansteckung bis Symptombeginn) mit zunehmenden Immunisierungsgrad abgenommen hat (Wu et al.). Dementsprechend zeigte sich in Studien, dass der Viruslast-Peak (Gipfel) bei Geimpften im Schnitt erst nach Symptombeginn auftrat (Kandel et al., Hay et al., Marking et al., Takahasi et al., Townsley et. al., Winnett et al. (a), Winnett et al. (b)). Dadurch kommt es (auch laut Christian Drosten) in den ersten Tagen nach Symptombeginn bei Geimpften/Genesenen wahrscheinlich häufig(er) zu falsch-negativen Ergebnissen, weil die RNA-Viruslast bzw. die Antigen-Konzentration noch nicht hoch genug (oft noch nicht ansteckend) ist. Daher bitte trotz negativem Antigentest bei bzw. kurz nach Symptombeginn in den nächsten Tagen weiter testen!
- Bei Vorimmunisierten ist die Sensitivität der Antigentests bezogen auf dieselbe RNA-Viruslast möglicherweise im Schnitt geringer als bei Immunnaiven (siehe v.a. Studiengrafik 5B in Meiners et al.). Eine mögliche Erklärung (u.a. von Victor Corman) dafür ist, dass bei Vorimmunisierten wahrscheinlich weniger Zellen infiziert werden (vgl. Mostaghimi et al.), wodurch die Antigen-Konzentration im Verhältnis zur RNA-Konzentration stärker abnehmen würde*. Damit zusammenhängend sind vollständig Geimpfte/Geboosterte und Genesene jedoch wahrscheinlich gleichzeitig für wenige Monate nach der letzten Impfung/Infektion im Schnitt weniger/seltener/kürzer ansteckend als Immunnaive (Real-Life-Studien: Madewell et al., Sun et al., Tan et al.; Laborstudien: Puhach et al., Peña-Hernández et al., Hakki et al., Garcia-Knight et al.). Abgesehen von einer potenziellen (eher kleinen) "Sensitivitätslücke" zu Beginn der Infektiosität (siehe unten) sollten Antigentests also auch bei Geimpften/Geboosterten bei potenzieller Ansteckungsfähigkeit gut (zu im Schnitt 85-95%) anschlagen (Cosimi et al., Luna-Muschi et al.).
*Hintergrund: Das Verhältnis von N-Protein (= Antigen, auf das fast alle Antigentests testen) zu RNA fällt in infizierten Zellen wahrscheinlich zugungsten von N-Protein aus. Auch wenn der RNA-Viruslast-Peak bei Geimpften und Ungeimpften (mittlerweile) ähnlich ist, ist (neben der Fläche unter der infektiösen Viruslast-Kurve auch) die Fläche unter der RNA-Viruslast-Kurve (AUC) bei Geimpften wahrscheinlich kleiner (Garcia-Knight et al., Kissler et al., Hakki et al., Hay et al.). Dafür, dass bei infizierten Geimpften weniger (freies) N-Protein verfügbar ist, spricht laut Victor Corman, dass hier auch die Konzentration der gegen das N-Protein gerichteten Antikörper geringer ausfällt (Whitaker et al., Follmann et al., Scurr et al.). - Es ist gut möglich, dass die Sensitivität der Antigentests bezogen auf dieselbe RNA-Viruslast am Anfang der Infektion noch geringer ist als im weiteren Verlauf der Infektion (siehe v.a. Studiengrafik 5A in Meiners et al.). Eine mögliche Erklärung (u.a. von Christian Drosten) für diese "Sensitivitätslücke" ist, dass es anfangs wahrscheinlich noch nicht genug infizierte, abgestorbene Schleimhautzellen, die mit N-Protein beladen sind, gibt* (Meiners et al.). In Verlaufsstudien (Längsschnittstudien) mit Ungeimpften ("Wildtyp"/Pre-Alpha, Alpha, Delta) und Geimpften (Delta), wo täglich Proben für den PCR-Test, den Antigentest und die Viruskultur (Virusanzucht) genommen wurden, schlugen die Antigentests immerhin im Schnitt(!) erstmals innerhalb der ersten 24 Stunden nach dem erstmaligen Nachweis von "lebendem" Virus an (Hakki et al., Killingley et al., Ke et al., Smith et al.). Die anfängliche infektiöse Phase ("Sensitivitätslücke"), die die Antigentests also grundsätzlich verpassen (würden), dürfte im Schnitt wahrscheinlich eher ≤24 Stunden als mehrere Tage betragen. Zwei Studien von Soni et al. und Winnet et al. (a) mit Selbsttests deuten zumindest darauf hin, dass das bei Omikron (BA.1, BA.1.1) und Geimpften (bezogen auf die Erkennung von potenziell infektiösem Virus in der Nase) nicht sehr anders ist.
*Hintergrund: Aus abgestorbenen (nicht mehr intakten) Zellen wird wahrscheinlich mehr N-Protein (Antigen) detektierbar sein als aus infizierten, aber noch intakten (lebenden) Zellen oder Virionen, die erst durch den Lysepuffer des Antigentests "aufgebrochen" werden müssen. - Da sich die Viruskinetik (zeitlicher Verlauf der RNA-Viruslast) in Nasenrachen (Nasopharynx), Mundrachen (Oropharynx), Nase und Speichel offenbar unterscheidet (Wildtyp: Killingley et al., Alpha: Ke et al., Omikron: Cornette et al, Lin et al., Winnett et al. (a), Winnett et al. (b)) kann es sein, dass die RNA-Viruslast bzw. die Antigen-Konzentration in einem Kompartiment bereits (oder noch) ausreichend ist, damit der Antigentest anschlägt, in einem anderen aber noch nicht (oder nicht mehr). Ein kombinierter Rachen- und Nasenabstrich z.B. erhöht dementsprechend die Sensitivität der Antigentests im Schnitt um ca. 5-20%-Punkte (siehe dazu ausführlicher unter Frage 2). Wichtig: Die RNA-Viruslast und damit auch die Antigen-Konzentration im Speichel ist wahrscheinlich oft nicht bzw. nur für einen relativ kurzen Zeitraum ausreichend (Cornette et al., Golden et al., Ke et al., Lai et al., Lin et al. Kritikos et al., Savela et al., Winnett et al. (a), Winnett et al. (b)), damit die bei uns als Selbsttest erhältlichen Spuck- und Lollitests zuverlässig (zu ≥90% im Vergleich zum PCR-Test) anschlagen können (siehe für Omikron z.B. de Meyer et al.).
- Christian Drosten wies darauf hin, dass es (wahrscheinlich ähnlich wie bei Influenza) bei bereits (Mehrfach)Infizierten sein könnte, dass Antikörper in der abgenommenen (Nasen-)Probe, die sich gegen das N-Protein (Antigen) richten (und nach Infektion, nicht nach Impfung mit mRNA- oder Vektorimpfstoffen gebildet werden!), die Testreaktion stören könnten, indem sie die Bindungsstellen (Epitope) im N-Protein für die (das Antigen nachweisenden) Antikörper der Antigentests teils belegen. Zwar wurde in einzelnen Studien eine (mal mehr, mal weniger) geringere (Gesamt-)Sensitivität von Antigentests bei vorher Infizierten festgestellt (Schuit et al. (a), Schuit et al. (b), Venekamp et al.), jedoch wurde in keinem Fall nach RNA-Viruslast (oder gar Viruskultur-Positivität) differenziert, so dass die Daten nicht aussagefähig zur Überprüfung der Hypothese sind (das merkt man schon daran, dass in einem Fall die Gesamt-Sensitivität bei vorher Infizierten sogar höher war).
- In einem späten Stadium der (akuten) Infektion kommt es häufig(er) vor, dass man trotz hoher RNA-Viruslast in Folge neutralisierender Antikörper (nicht nur durch ggf. vorherige Infektion und/oder Impfung, sondern auch durch die aktuelle Infektion induziert) nicht mehr ansteckend ist, so dass Antigentests nicht mehr anschlagen (z.B. van Kampen et al. i.V.m. Ke et al., Luna-Muschi et al.).
- Die Abstrichqualität spielt ebenfalls, aber m.E. eine weniger große Rolle als anfangs befürchtet - zumindest bezogen auf den vorderen Nasenabstrich, der für sich genommen bereits eine relativ gute Sensitivität bei hohen RNA-Viruslasten aufweist (siehe weiter oben bzw. Brümmer et al.), weil diesen selbst Kinder relativ zuverlässig selbst durchführen können (Altamirano et al., Cohen et al., Engels et al., Waggoner et al.). Aber auch der Rachen-Selbstabstrich wird von Erwachsenen meist korrekt durchgeführt (García-Fiñana et al., Goodall et al., Schuit et al. (a), Shakir et al.).
4. Wie wahrscheinlich ist es, dass die Sensitivität von Antigentests bei den neuen Varianten BQ.1/BQ.1.1, BF.7, XBB.1/XBB.1.5/XBB.1.16, EG.5/EG.5.1 oder BA.2.86 beeinträchtigt ist?
Letztes Update: 26.09.2023
Laut einer Laborstudie (Sakai-Tagawa et al.) fiel die analytische Sensitivität von 7 Antigentests bei den Varianten BA.2.75, BQ.1.1, BF.7 und XBB.1 ähnlich aus wie bei früheren Varianten (Delta und BA.5).
Eine (retrospektive) Laborstudie (Anderson et al.) weist zudem darauf hin, dass die Sensitivität zweier Antigentests u.a. bei BQ.1 und XBB.1.5 ("Kraken") ähnlich (nicht signifikant unterschiedlich) wie bei den vorherigen Varianten ausfällt, was kurz darauf durch eine weitere (retrospektive) Laborstudie (Osterman et al. (c)) für 4 (laborbasierte) Antigentests bestätigt wurde.
Studien zur Sensitivität von Antigentests bei den Varianten XBB.1.16 ("Arcturus"), EG.5 ("Eris"), EG.5.1 und BA.2.86 ("Pirola") liegen m.W. noch nicht vor.
Laut CoV-Spectrum liegt - mit Stand 26.09.2023 - im N-Protein (= Antigen, auf das nahezu alle Antigentests testen) von BQ.1/BQ.1.1 und BA.2.86 jeweils nur eine neue (bisher unbekannte) Mutation (an Position 136 bzw. 229), im N-Protein von BF.7 nur zwei neue Mutationen (an den Positionen 30 und 33) und im N-Protein von BA.2.75/XBB.1/XBB.1.5/XBB.1.16/EG.5*/EG.5.1 keine neue Mutation vor.
*Ca. 10% der Genom-Sequenzen von EG5 enthalten im N-Protein an Position 161 eine Mutation (Austausch der Aminosäure Leucin mit der Aminosäure Phenylalanin), die bereits bei der Delta- Subvariante AY.39 auftrat.
Obwohl sich die neue Mutation bei BQ.1/BQ.1.1 in der N-terminalen Domäne (NTD) des N-Proteins befindet, in der laut Paul-Ehrlich-Institut (PEI) die Antikörper der Mehrheit der Antigentests binden, ist es m.E. unwahrscheinlich, dass die Mutation die analytische Sensitivität (Nachweisgrenze = kleinste Antigen-Konzentration, die vom jeweiligen Antigentest noch zuverlässig [zu 95-100%] nachgewiesen werden kann) der allermeisten Antigentests beeinträchtigt (Update: siehe bestätigend Sakai-Tagawa et al. und Anderson et al.), weil..
- es sich nur um einen einzigen Aminosäure-Austausch (Substitution) handelt.
- die Aminosäure Glutamat durch die Aminosäure Aspartat ausgetauscht ist (= die einzigen beiden negativ geladenen Aminosäuren).
- die N-terminale Domäne (NTD) aus über 120 bzw. das N-Protein aus über 400 Aminosäuren besteht.
- Antigentests oft unterschiedliche Antikörper nutzen, die, sofern sie in der NTD binden, in verschiedenen Regionen der NTD binden (Frank et al.).
- die Mutation (dieser spezielle Aminosäure-Austausch an Position 136) laut Frank et al. für die darin untersuchten Antikörper von Antigentests, die in der NTD binden, wahrscheinlich keinen merklichen Einfluss auf deren Bindung hat.
- die jeweilige Mutation in der NTD von Delta und Gamma auch keine merklichen Auswirkungen auf die Sensitivität von Antigentests hatte (soweit untersucht).
Obwohl BF.7 zwei neue Mutationen im N-Protein aufweist, ist es m.E. auch eher unwahrscheinlich (wenn auch etwas wahrscheinlicher als bei BQ.1/BQ.1.1), dass die Mutationen die analytische Sensitivität (siehe oben) der allermeistens Antigentests beeinträchtigen (Update: siehe bestätigend Sakai-Tagawa et al. und Anderson et al.), weil..
- es sich nur um 2 Mutationen handelt (einen Aminosäure-Austausch [Substitution] an Position 33 und einen Aminosäure-Verlust [Deletion] an Position 30).
- es bei den vorherigen Omikron-Varianten an Position 33 (und übrigens auch an den Positionen 31 und 32) einen Aminosäure-Verlust gab (nun liegt dort ein Aminosäure-Austausch vor), der offensichtlich keine merklichen Auswirkungen auf die Antigentest-Sensitivität hatte (sofern untersucht; siehe oben unter Frage 1).
- der spezielle Aminsäure-Austausch an Position 33 laut Frank et al. für die darin untersuchten Antikörper von Antigentests (Punkt 2 entsprechend) wahrscheinlich keinen merklichen Einfluss auf deren Bindung hat (nur der Antikörper "mAb 1C1" hat einen mittleren "Escape score").
- laut Paul-Ehrlich-Institut (PEI) die allermeisten Antigentests nicht in der Region der neuen Mutationen binden.
Es ist m.E. unwahrscheinlich, dass die neue Mutation (Austausch der Aminosäure Glutamin mit der Aminosäure Lysin an Position 229) im N-Protein von BA.2.86 die analytische Sensitivität (siehe oben) der allermeisten Antigentests beeinträchtigt (bzw. beeinträchtigen würde, sofern sich BA.2.86 durchsetzen würde), weil sich die Mutation in der sogenannten "linker region" des N-Proteins befindet, in/an der laut Paul-Ehrlich-Institut (PEI) nur ca. 5% von 428 Antigentests mit ihren Antikörpern binden, wobei davon wiederum wahrscheinlich nur ein Bruchteil an der mutierten Position bindet (siehe bestätigend Frank et al.).
Bei BA.2.75/XBB.1/XBB.1.5/XBB.1.16/EG.5/EG.5.1 liegt - wie oben bereits erwähnt - wiederum keine neue Mutation im N-Protein vor, so dass es auch hier m.E. jeweils unwahrscheiblich ist, dass die analytische Sensitivität der allermeisten Antigentests beeinträchtigt ist.
Ergo: Die Antigen-Konzentration, die in der Probe mindestens vorliegen muss, damit der Antigentest zuverlässig anschlägt, wird für die allermeisten Antigentests bei den neuen o.g. Varianten m.E. wahrscheinlich unverändert sein (Update: siehe bestätigend für BA.2.75, BQ.1/BQ.1.1, BF.7, XBB.1/XBB.1.5 Sakai-Tagawa et al. und Anderson et al.).
Die klinische Sensitivität (Wahrscheinlichkeit, dass ein Antigentest eine infizierte Person erkennt, i.d.R. im Vergleich zum PCR-Test bestimmt) ist vom Testzeitpunkt abhängig (weil sich die RNA-Viruslast und damit die Antigen-Konzentration im Infektionsverlauf ändert) und könnte unabhängig von der analytischen Sensitivität bei einer neuen Variante (je nach Testzeitpunkt) reduziert sein.
So könnte bei einer neuen Variante der Zeitraum am Anfang der Infektion, in dem die Nachweisgrenze des Tests noch unterschritten ist, im Schnitt länger werden (z.B. wenn sich die Viruskinetik entsprechend ändert oder das Verhältnis von Antigen- zu RNA-Konzentration kleiner wird), so dass Antigentests im Infektionsverlauf erst im Schnitt etwas später zuverlässig (in der Praxis zu im Schnitt ≥90% im Vergleich zum PCR-Test) anschlagen würden.
Davon unabhängig könnte eine geringere minimale Infektionsdosis die Erkennungsrate infektiöser Personen (am Anfang der infektiösen Phase) reduzieren. Good to know: Bisher lag die Nachweisgrenze (analytische Sensitivität) der meisten Antigentests im Bereich der "Infektiositätsschwelle" (= RNA-Viruslast, unter der die Virusanzucht im Labor unwahrscheinlich ist; siehe auch oben unter Frage 3).
Übrigens wäre es auch möglich, dass die klinische Sensitivität bei einer neuen Variante (je nach Testzeitpunkt) höher ausfällt.
Die vorliegende Evidenz für die bisherigen (VOC-)Varianten weist auf keine merklich veränderte klinische Sensitivität der untersuchten Antigentests hin (siehe z.B. oben unter Frage 1), was nicht verwundert, da es bisher (auch) immer nur einzelne oder bei einigen Omikron-Subvarianten keine neuen (bisher unbekannten) Mutationen im N-Protein gab.
Von einem möglichen Varianteneinfluss unabhängig ist die klinische Sensitivität (im Vergleich zum PCR-Test) nun jedoch um den Symptombeginn herum offensichtlich bedingt durch einen früheren Symptombeginn bei Vorimmunisierten wahrscheinlich im Schnitt verringert (siehe dazu ausführlicher oben unter Frage 3).
Ausblick: Da bei Vorimmunisierten (je nach vergangener Zeit nach der letzten Impfung/Infektion) die Wahrscheinlichkeit, (bei gleicher RNA-Viruslast) infektiös zu sein, wahrscheinlich kleiner ist (als bei Immunnaiven), und (damit zusammenhängend) das Verhältnis von Antigen- zu RNA-Konzentration möglicherweise kleiner ist (als bei Immunnaiven) (siehe dazu ausführlicher oben unter Frage 3), und eine neue Variante zusätzlich Einfluss auf das Verhältnis von Antigen- zu RNA-Konzentration haben könnte (siehe oben), werden zukünftige Studien zur Sensitivität von Antigentests immer schwerer zu interpretieren sein (weil das Verzerrungsrisiko der Ergebnisse erhöht ist).
Wahrscheinlich werden zukünftige Studien (aus oben genannten Gründen) eine geringere (Gesamt-)Sensitivität (über den gesamten Infektionsverlauf im Vergleich zum PCR-Test) zeigen, wobei in dem Fall zu untersuchen wäre bzw. es relevant bleibt, wie gut Antigentests (weiterhin) potenziell infektiöse Proben erkennen können. Daher sollten Antigentest- Ergebnisse nicht mehr bevorzugt mit PCR-Test-Ergebnissen (RNA-Viruslasten oder gar Ct- Werten) verglichen werden, sondern bevorzugt mit dem (Kultivierungs-)Erfolg, "lebendes" (potenziell ansteckungsfähiges) Virus aus den jeweiligen Proben im Labor (in Zellkultur) anzüchten zu können (leider relativ aufwendig).
Retrospektive Laborstudien mit (zwischen)gelagerten Proben haben durchaus ihre Berechtigung, sollten aber (v.a. von den Medien) nicht vorschnell als gegebene Evidenz interpretiert werden, da deren Ergebnisse generell methodischen Limitationen/einem Verzerrungsrisiko unterliegen (z.B. kann es allein methodisch bedingt dazu kommen, dass das Verhältns von Antigen- zu RNA-Konzentration der Proben im Schnitt kleiner wird; siehe dazu ausführlicher oben unter Frage 1). So deuteten z.B. die ersten beiden retrospektiven Laborstudien für die BA.1-Variante zunächst auf eine verringerte Sensitivität von Antigentests im Vergleich zu Delta hin, was sich dann aber in Folgestudien nicht bestätigen konnte (siehe unter Frage 1).
Am aussagefähigsten/relevantesten sind prospektive klinische (Real-Life-)Studien (mit frischen Proben), die die Sensitivität von Antigentests im Vergleich zum Erfolg der Virusanzucht in Zellkultur (also nicht [nur] im Vergleich zum PCR-Test) untersuchen (wobei die Proben für den Antigentest und die Viruskultur auf dieselbe Art abgenommen werden sollten). Sofern Letzteres nicht möglich ist (weil sehr aufwendig), sollten die Ergebnisse idealerweise nicht nur nach RNA-Viruslast und Abstrichart, sondern auch nach nach Immunstatus (wie oft und womit geimpft/infiziert, wann jeweils zuletzt?), Testzeitpunkt (wie viel Tage nach Symptombeginn/Exposition?) und Variante (gemäß Sequenzierung) differenziert werden (gilt auch für retrospektive oder analytische Laborstudien mit Archivproben), da die letztgenannten Faktoren das Verhältnis von Antigen- zu RNA-Konzentration eventuell beeinflussen könnten (siehe oben und unter Frage 3).
Wird die Sensitivität bei unterschiedlichen Varianten auf Basis von unterschiedlichen Proben (in prospektiven klinischen Studien mit frischen Proben oder in retrospektiven oder analytischen Laborstudien mit Archivproben) verglichen, sollte man die Proben möglichst matchen (vergleichbar machen). Im Falle von Archivproben nicht nur in Bezug auf die RNA- Viruslast, die Abstrichart, den Immunstatus und den Testzeitpunkt, sondern auch hinsichtlich des genutzten (Proben-)Transportmediums und der (Proben-)Lagerung (Temperatur und Zeit, wobei Letzteres praktisch oft schwierig ist), da auch die letztgenannten Faktoren das Verhältnis von Antigen- zu RNA-Konzentration beeinflussen können (siehe dazu ausführlicher unter Frage 1). Sollte keine Viruskultur (zur Bestimmung der Test-Sensitivität im Vergleich zum Erfolg der Virusanzucht) möglich sein, könnte man auch die Antigen-Konzentrationen der (gematchten) Proben vorab mit einem quantitativem Antigentest bestimmen, um das Verhältnis von Antigen- zu RNA-Konzentration bei den verglichenen Proben (mit unterschiedlichen Varianten) zu bestimmen (was aber nur Sinn macht, wenn bekannt ist, dass die Sensitivität des quantitativen Antigentests bei den untersuchten Varianten ähnlich ist). Sollte sich das Verhältnis von Antigen- zu RNA- Konzentration in den verglichenen (gematchten) Proben (mit unterschiedlichen Varianten) unterscheiden, ist es zu erwarten, dass sich die Sensitivität (zumindest im Vergleich zum PCR- Test*) ebenfalls unterscheidet (*die analytische Sensitivität [definiert als kleinste Antigen- Konzentration, die vom Antigentest noch zuverlässig erkannt werden kann] und die Sensitivität im Vergleich zur Viruskultur kann davon unberührt sein!). In dem Fall ist es zu klären, ob das unterschiedliche Verhältnis von Antigen- zu RNA-Konzentration der verglichenen Proben an einem unzureichenden Matching der Proben oder den unterschiedlichen Varianten per se liegt.
Übrigens: In der Publikation von Frank et al. wird eine Methode beschrieben, mit der sogenannte Escape-Mutationprofile (in der Art eines Fingerabdrucks) für die in den jeweiligen SARS-CoV-2- Antigentests genutzten monoklonalen Antikörper erstellt werden können, mit denen man in der Folge bei allen zukünftigen SARS-CoV-2-Varianten relativ gut/genau voraussagen kann bzw. könnte, ob die ggf. neuen Mutationen im N-Protein (Antigen) der neuen Variante die analytische Sensitivität des jeweiligen Antigentests beeinträchtigen werden.
Autor: Christian Erdmann, FH Münster, keine Interessenkonflikte, u.a. Mitautor einer einschlägigen Meta-Analyse und eines einschlägigen systematischen Reviews im Auftrag der WHO.
Hinweis: Es wurden auch einige Preprints (nicht begutachtete Vorab-Publikationen) zitiert/verlinkt, aber nicht immer gekennzeichnet (erkennbar an der URL medrxiv.org, papers.ssrn.com und researchsquare.com).
Artikelbild: Covid-19 Antigen tests on blue background by Marco Verch under Creative Commons 2.0